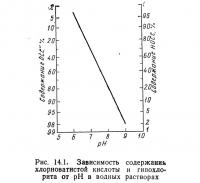
При низких концентрациях хлора (менее 1000 мг/л) и pH выше 3 практически весь хлор переходит в HOCl.
В водных растворах хлорноватистая кислота диссоциируется на ионы OCl- и водорода:
Эта реакция зависит от pH (рис. 14.1).
Гипохлориты, например гипохлорит кальция, при растворении в воде диссоциируют:
Как видно из уравнения (14.11), ионы гипохлорита находятся с хлорноватистой кислотой в равновесии.
Хлор, HOCl и OCl- — сильные окислители и поэтому вступают в реакцию и образуют различные соединения со многими химическими веществами. Одним из наиболее важных соединений, которое легко вступает в реакцию с хлорноватистой кислотой, является аммиак.
При взаимодействии хлорноватистой кислоты с аммиаком может образоваться монохлорамин, дихлорамин или трихлорамин (трихлорид):
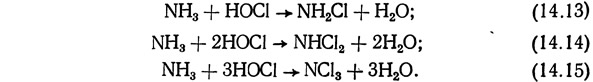
Хлорамины могут образоваться также в результате реакции НОС1 с органическими аминами, содержащимися в растворе. Постоянные равновесия для уравнений (14.13) — (14.15) зависят от pH, температуры раствора и соотношения концентраций NH3 и HOCl. Соотношение в растворе аммиака (NH3) и аммония NH+4 также зависит от pH.
HOCl и OCl- часто называют свободным хлором, а хлорамины — связанным хлором. Токсичность свободного хлора и его соединений неодинакова для разных микроорганизмов и высших водных животных, наиболее токсичен свободный хлор. Соединение хлора удалить из раствора труднее, чем свободный хлор, поэтому чаще специально пользуются соединениями хлора, которые имеют более длительный срок остаточного воздействия.
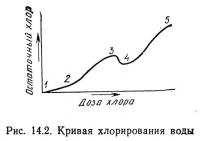
В воде систем для культивирования содержится множество органических и неорганических соединений. Внесение в воду хлора обычно приводит к появлению некоторого его избытка, который называется остаточным хлором (рис. 14.2). По мере увеличения содержания хлора в воде кривая поднимается слева направо в виде ломаной линии. При увеличении дозы внесенного хлора от точки 1 к точке 2 он вступает в реакцию с находящимися в воде восстановителями: нитритами и ионами железа, при этом хлор восстанавливается до хлорида. Далее при увеличении дозы внесенного хлора от точки 2 к точке 3 он не расходуется на окисление восстановителей, так как все они окислены и дальнейшее увеличение концентрации хлора ведет к образованию хлораминов, которые в свою очередь являются сложными соединениями свободного хлора с длительным сроком остаточного воздействия.
В точке 3 весь аммиак и органические амины уже вступили в реакцию с хлором, и свободный остаточный хлор начинает восстанавливаться. Концентрация свободного остаточного хлора становится критической и достаточной для начала процесса окисления хлораминов, образовавшихся в результате взаимодействия хлора и аммиака. Содержание остаточного хлора уменьшается и образуется соединения окисленного азота, такие, как трихлорамин (NCl3) и закись азота. Особенно сложный процесс окисления хлораминов наблюдается при дальнейшем увеличении дозы хлора от точки 3 до точки 4 (рис. 14.2). Точка 4 обычно считается точкой перегиба.
После прохождения точки 4 остаточный хлор находится в виде устойчивых хлораминов, которые образуются в результате реакции хлора с органическими аминами и последующего взаимодействиях активным хлором.
Рич (Rich, 1963) считает, что скорость гибели микроорганизмов под действием хлора описывается следующим уравнением:
Интегрируя уравнение (14.15) и логарифмируя его по основанию 10, получаем
где все обозначения те же, что и в уравнениях (14.1) и (14.2).
Использование хлора в качестве дезинфицирующего вещества для борьбы с различными микроорганизмами весьма опасно для культивируемых объектов. Большинство водных организмов очень чувствительны даже к низким концентрациям хлора (табл. 14.1).
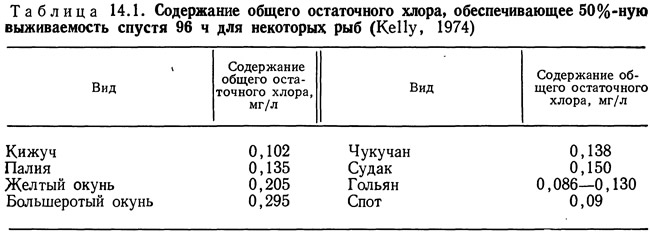
Кроме того, хлор и хлорамины весьма токсичны (Kelly, 1974), поэтому применение хлора в качестве дезинфицирующего вещества в системах для культивирования организмов требует длительной экспозиции с тем, чтобы из выростных емкостей был удален весь активный хлор и хлорамины. Для обработки сточных вод обычно требуется около 30 мин при содержании 1—2 мг/л остаточного хлора в конце обработки. Однако Лиу и др. (Liu et al., 1971) установили, что время контакта, необходимое для гибели 99,99% различных вирусов при температуре 2°С и, содержании остаточного свободного хлора 0,5 мг/л, варьирует от 2,7 до 120 мин.
Хлор и хлорамины можно удалить из воды химическим путем или с помощью адсорбции. Наиболее эффективной считается адсорбция с помощью активного древесного угля. Для удаления хлора и хлораминов из воды можно использовать такие восстановители, как тиосульфат натрия и соли железа (Coventry, 1935). Однако вносимые в воду химикаты и продукты их реакции следует перед употреблением проверять на токсичность по отношению к культивируемым объектам. Хлор можно удалять также путем аэрации воды. Полная аэрация действительно удаляет весь хлор, но некоторые исследователи сомневаются, что аэрация способна удалить хлорамины, особенно из воды, содержащей большое количество органических веществ.
Из-за токсичности хлора и хлораминов для водных объектов особую осторожность необходимо проявлять при дезинфекции воды, используемой для культивирования. Даже при удалении остатков дезинфицирующего вещества с помощью активного угля перед подачей воды в замкнутые или полузамкнутые системы опасность гибели культивируемых организмов от хлора велика.