Поверхностная избыточная концентрация
Поскольку адсорбция — это поверхностное явление (т. е. происходящее на поверхности или на поверхности раздела), на нее значительное влияние оказывают реакции и свойства поверхности. Если каплю воды поместить на чистую вощеную поверхность, то образуется не тонкая пленка, а капельки. Когезионные силы между молекулами воды больше адгезионных сил между водой и воском или между молекулами воздуха и воды, поэтому вода сжимается, и образуются капельки. Неуравновешенная сила стремится сжать воду для уменьшения площади поверхности. Адгезионная сила между молекулами воды или иной жидкости на поверхности раздела называется поверхностным натяжением, уменьшить которое можно путем добавления в воду некоторых растворимых, веществ. Вещества, уменьшающие поверхностное натяжение жидкости, называются смачивающими или поверхностно-активными веществами; к таким веществам относятся хорошо известные детергенты. Благодаря большему притяжению между молекулами воды, чем между водой и поверхностно-активным веществом, последнее будет аккумулироваться на границе раздела или на поверхности. В приведенном выше примере концентрация поверхностно-активного вещества на границе раздела воздух — вода уменьшает количество энергии, необходимое для увеличения площади поверхности капельки, что позволяет капелькам разлиться и образовать пленку.
В 1878 г. Гиббс вывел уравнение, связывающее концентрацию на поверхности, во много раз превышающую концентрацию в объеме раствора (обычно называемую поверхностной избыточной концентрацией Г), и концентрацию ионного растворенного вещества в растворе с). Строго говоря, в уравнении Гиббса следовало бы использовать активности, но концентрации определить гораздо легче, а они почти равны:
где Г — поверхностная избыточная концентрация; с — концентрация; R — универсальная газовая постоянная; у — поверхностное натяжение; dy/dc— наклон кривой зависимости между поверхностным натяжением и концентрацией; Т — абсолютная температура.
Уравнение Гиббса является основным уравнением, описывающим адсорбцию на поверхности раздела между жидкостью и газом или между жидкостью и твердым телом. Оно показывает, что поверхностная избыточная концентрация Г прямо пропорциональна наклону кривой зависимости между поверхностным натяжением и концентрацией. Знак «минус» показывает, что Г возрастает с увеличением крутизны отрицательного наклона. Теоретически уравнение Гиббса применимо только к системе, находящейся в состоянии равновесия и при концентрациях мицелл ниже критических.
Силы адсорбции
Лиофобность растворенного вещества и его сродство к адсорбенту являются, по-видимому, движущими силами адсорбции.
Растворимость растворенного вещества в растворителе является основным фактором, определяющим лиофобные характеристики растворенного вещества. Чем выше растворимость данного вещества в данном растворителе, тем менее вероятно его перемещение и аккумуляция на поверхности раздела. И наоборот, чем меньше растворимость вещества, тем больше вероятность его аккумуляции на поверхности раздела. В случае водных растворов водорастворимые соединения называют гидрофильными, а малорастворимые — гидрофобными. Органические соединения могут быть и гидрофильными, и гидрофобными или могут состоять из молекул, один конец которых является гидрофильным, а другой — гидрофобным. Молекулы этого последнего типа ориентируются на поверхности или на поверхности раздела так, что их гидрофобная часть находится на поверхности, а гидрофильная — в растворителе. Специфичное сродство растворенного вещества к адсорбенту является второй важной движущей силой адсорбции. Согласно современным концепциям силы притяжения, вызывающие сродство между растворенным веществом и адсорбентом, делятся на электрическое притяжение растворенного вещества к адсорбенту, Ван-дер-Ваальсовы силы и химическое взаимодействие.
Электрическое притяжение — это процесс связывания электрически заряженных частиц с другими, противоположно заряженными частицами. Это явление, называемое ионным обменом или обменной адсорбцией, более подробно рассмотрено ниже. Здесь достаточно отметить, что этот процесс заключается в адсорбции ионов из раствора на заряженных участках адсорбента. Адсорбируемые ионы замещают ионы, уже находящиеся на заряженном участке. Таким образом, адсорбция зависит от заряда иона. Поскольку температура для всех ионов в конкретной точке одинакова, средняя кинетическая энергия одноразмерных ионов также одинакова. Таким образом, чем выше ионный заряд молекулы, тем больше ее потенциальная адсорбируемость. Трехвалентные ионы замещают двухвалентные, а двухвалентные — одновалентные. Для равнозаряженных молекул порядок адсорбции определяется размером молекул, причем наиболее интенсивно адсорбируются самые мелкие ионы: чем меньше ион, тем он ближе подходит к участку адсорбции и прочнее удерживается.
Наиболее слабый из процессов адсорбции — в результате действия Ван-дер-Ваальсовых сил — называют физической адсорбцией. Согласно существующим теориям физическая адсорбция не связывает молекулу с определенным участком поверхности, а позволяет частице совершать поступательное движение в пределах поверхности.
Химическая или активированная адсорбция предполагает возникновение химической реакции между адсорбентом и адсорбатом (т. е. адсорбируемым веществом) на участке адсорбции. Химическая адсорбция создает прочную связь между адсорбентом и адсорбатом на химически активных участках адсорбента. Повышение температуры способствует химической адсорбции, так как при повышенных температурах химические реакции ускоряются.
На практике движущими силами адсорбции обычно выступают две или более из описанных выше сил. Разделение адсорбции на типы, по сути дела, невозможно из-за их взаимодействия, что особенно относится к химической и физической адсорбции. Разные типы адсорбции могут происходить одновременно или последовательно.
Адсорбция с помощью активного угля
Изотермы адсорбции. Адсорбцию на твердое вещество, находящееся на границе между жидкостью и твердым телом, часто характеризуют изотермами адсорбции. Изотерма адсорбции — это кривая, получаемая на графике зависимости X от С. X — это количество растворенного вещества, адсорбированного на единицу веса твердого адсорбента, а С — концентрация растворенного вещества, оставшегося в растворе после установления равновесия. Точку равновесия можно определить, поместив в раствор некоторое количество адсорбента и перемешав его. В какой-то момент адсорбция растворенного вещества прекратится, это и будет точкой равновесия.
Существует два уравнения изотермы адсорбции, выведенные теоретически, и еще одна, полученная на основании эмпирических наблюдений. В основу уравнения Лангмюра положено предположение о том, что адсорбция происходит в одном молекулярном слое над доступной поверхностью. Математически эта теория описывается следующим уравнением (Weber, 1969):
где X — количество растворенного вещества, адсорбированного на единицу веса твердого адсорбента; Xm — число грамм-молекул растворенного вещества, адсорбированного при образовании сплошного монослоя на поверхности адсорбента; С — концентрация растворенного вещества в растворе после установления равновесия; b — константа, характеризующая энергию адсорбции.
Графически зависимость 1/Х от 1/С по уравнению (16.32) имеет вид прямого отрезка 1/Xm с наклоном 1/bXm.
Второе теоретически выведенное уравнение изотермы адсорбции — уравнение Брунауэр — Эмметт — Теллера (БЭТ) — допускает многослойную адсорбцию растворенного вещества на поверхности адсорбента:
где Cs — концентрация насыщения растворенного вещества в растворителе при данной температуре, А — константа, выражающая энергию взаимодействия с поверхностью; С, X, Xm — те же, что и в уравнении (13.32).
Уравнение (13.33) на графике зависимости C/[(CS—С)Х] от C/Cs выражается прямым отрезком 1 /АХн и наклоном (А—1)/AXm.
Изотерма адсорбции Фрейндлиха выводится эмпирически и описывается следующим уравнением:
где К и n — константы, а X и С — как указано выше.
Уравнение (13.34) обычно преобразуют в линейное уравнение, которое на графике с логарифмической сеткой имеет вид прямой отрезка log K с наклоном 1/n:
Уравнения (13.32), (13.33) и (13.35) можно использовать для определения количества адсорбента X, необходимого для извлечения требуемого количества растворенного вещества из заданного объема отработанных вод. Уравнение Фрейндлиха (13.35) применяется также для определения количества активного угля, которое необходимо добавить при обработке воды' на городских очистных установках для устранения посторонних привкуса, запаха и примесей. Его обычно применяют в виде
где Ci — концентрация загрязняющего вещества в воде, поступающей в очистную установку; D — количество угля, которое необходимо добавить в воду для достижения требуемой концентрации загрязняющего вещества в воде, выходящей из установки; С — концентрация загрязняющего вещества в воде, выходящей из установки; K, n — константы.
Следует отметить, что изотермы адсорбции применимы ко всем адсорбционным системам жидкость — твердое тело, а не только к системам с активным, углем.
К сожалению, чтобы установить, какое из этих трех уравнений больше всего подходит для конкретного случая и для определения констант, необходимо в каждом отдельном случае проводить лабораторные эксперименты. Только построив на основании экспериментов соответствующий график, можно рассчитать необходимое количество адсорбента. Необходимо подчеркнуть, что лабораторные испытания следует проводить именно с той отработанной водой, с той концентрацией растворенного вещества и адсорбентом, которые будут использованы в очистной установке.
Процесс адсорбции
Согласно уравнению Гиббса адсорбция прямо пропорциональна скорости уменьшения поверхностного натяжения на поверхности раздела. Уменьшение поверхностного натяжения пропорционально концентрации поверхностноактивного вещества на поверхности раздела до того момента, пока поверхностно-активное вещество полностью не покроет всю поверхность. Таким образом, скорость перемещения поверхностноактивного вещества к поверхности раздела влияет на скорость адсорбции. Вебер (Weber, 1969) считает, что для большинства растворов поверхностное натяжение уменьшается очень быстро и указывает временной интервал от менее одной секунды до нескольких минут. Однако опыт работы с отработанными водами свидетельствует, что адсорбция идет отнюдь не так быстро.
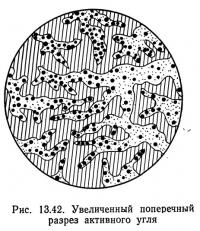
На рис. 13.42 показан схематический разрез гранулы активного угля. Процесс активации приводит к образованию в угле тысяч мелких трещин, что значительно увеличивает площадь его поверхности. Активный уголь может иметь площадь поверхности до 2,5·106 м2/кг, но чаще встречается уголь с площадью поверхности 1·106 м2/ кг (Environmental Protection Agency, 1973 а).
Адсорбция на активном угле — это процесс, протекающий в два или три этапа в зависимости от участка, где происходит адсорбция. На первом этапе, называемом пленочной диффузией, происходит перенос растворенного вещества сквозь пленку на поверхности активного угля. Второй этап — поровая диффузия — характеризуется диффузией адсорбата в порах или трещинах адсорбента. Адсорбат, который адсорбируется на внешней стороне активного угля, эту стадию минует. Третий этап — фактическая адсорбция адсорбата на повернхости активного угля. При некоторых условиях скорость адсорбции лимитируется диффузией сквозь поверхностную пленку. При значительной турбулентности скорость адсорбции лимитируется поровой диффузией. Вебер и Моррис (Weber and Morris, 1963) указывают на ограничение скорости адсорбции процессом поровой диффузии. Все изложенное объясняет почему адсорбция идет не так быстро, как это можно было бы предположить, исходя из скорости уменьшения поверхностного натяжения.
Параметры процесса при адсорбций углем
Эффективность адсорбции зависит от многих переменных. К сожалению, современный уровень знаний не позволяет получить общее количественное решение или заранее оценить влияние этих переменных. Тем не менее можно сделать определенные выводы и установить некоторые соотношения.
Площадь поверхности. Поскольку адсорбция является поверхностным явлением, она зависит от площади поверхности. Площадь поверхности зависит в свою очередь от исходного материала, из которого изготовлен активный уголь, способа его приготовления и размера частиц. Активный уголь получают из разных материалов, в том числе костей, угля, дерева, некоторых видов ореховой скорлупы (особенно скорлупы кокосового ореха и ореха-пекана), опилок, промышленных и сельскохозяйственных отходов. С уменьшением размера частиц угля площадь поверхности активного угля увеличивается. Поскольку площадь поверхности является важным фактором, целесообразно, чтобы она была как можно больше. Однако, как и в случае с песчаными фильтрами, мелкие частицы в неподвижных слоях быстро приводят к закупорке пор твердыми веществами, а также потере напора.
Концентрация растворенного вещества. Скорость адсорбции углем зависит от движущей силы, которая определяется градиентом концентрации между раствором и адсорбентом. Именно поэтому скорость адсорбции высока у нового или регенерированного активного угля и снижается по мере увеличения поверхностной избыточной концентрации. Высокая концентрация растворенного вещества также увеличивает скорость адсорбции. Скорость адсорбции и разность между концентрациями в растворе и на поверхности адсорбента связаны логарифмической зависимостью.
Вес растворенного вещества, адсорбированного единицей веса адсорбента, т. е. его адсорбционная способность, возрастает с увеличением концентрации растворенного вещества. Брюноттс и др. (Brunotts et al., 1973) показали, что логарифм веса растворенного вещества, адсорбированного на единицу веса угля, связан линейной зависимостью с логарифмом общего содержания органического углерода в промышленных стоках. Хотя это, по-видимому, верно и не во всех случаях, между концентрацией растворенного вещества и адсорбционной способностью часто существует логарифмическая зависимость. Интересно отметить, что адсорбционная способность угля часто реализуется не полностью, особенно в проточных системах. Адсорбционная способность до момента проскока часто зависит от скорости потока, pH и других переменных (Weber and Morris, 1965).
Свойства адсорбата. Свойства адсорбата влияют как ца скорость, так и на количество адсорбируемого адсорбентом вещества. Правило Лунделиуса определяет влияние свойств адсорбата на эффективность адсорбции: адсорбция из раствора увеличивается с уменьшением растворимости адсорбата в растворе.
Правило Траубе: адсорбция органических веществ из водного раствора закономерно увеличивается по мере возрастания гомологического ряда (т. е. по мере утяжеления, молекул в ряду). Поскольку молекулы с более длинной цепью проявляют тенденцию к меньшей растворимости в воде с увеличением длины цепи, правило Траубе тесно связано с правилом Лунделиуса.
Для ряда сульфированных алкилбензолов с разным размером молекул Вебер (Weber, 1969) показал, что скорость адсорбции уменьшается линейно. Хотя скорость адсорбции связана с размером молекул не всегда линейной зависимостью, размер и конфигурация молекул оказывают значительное влияние на скорость адсорбции и адсорбционную способность. Это и понятно, так как поровая диффузия часто является этапом, контролирующим скорость процесса адсорбции, а мелкие молекулы быстрее проникают в поры угля, чем крупные. И действительно, очень большие молекулы просто физически не могут пройти в мелкие поры. В таком случае адсорбционная способность уменьшается из-за сокращения площади, доступной для адсорбции.
Ионные свойства молекулы тоже могут иметь значение при адсорбции на угле. Вебер (1969) указывает, что вообще для структурно простых адсорбирующих молекул адсорбция максимальна для электрически нейтральных видов и минимальна для заряженных видов. В системах для культивирования водных организмов, содержащих значительное количество белковых веществ адсорбция углем должна быть максимальной в изоэлектрической точке белков и пониженной в других точках. Однако ионизация имеет гораздо меньшее значение в более сложных соединениях (Weber, 1969). К сожалению, для большинства белков изоэлектрическая точка лежит ниже pH 5. Такая концентрация водородных ионов неприемлема в системах культивирования водных организмов. pH раствора часто влияет на адсорбцию других ионов, поскольку ионы водорода и гидроокиси адсорбируются очень активно, кроме того, pH влияет на ионизацию кислых и основных растворов. Степень ионизации таких растворов иногда влияет на адсорбцию.
В общем случае органические примеси в воде лучше адсорбируются при снижении pH. Вебер и Моррис (1963) показали, что сульфированные алкилбензолы быстрее адсорбируются активным углем при уменьшении pH. Они предложили, что, поскольку сульфонаты алкилбензола заряжены отрицательно, нейтрализация отрицательных зарядов на поверхности угля уменьшает сопротивление диффузии и увеличивает адсорбцию.
Температура. Температура оказывает как прямое, так и косвенное влияние на процесс адсорбции. Косвенное влияние заключается в том, что температура влияет на вязкость и плотность воды. Поскольку температура является показателем кинетической энергии молекулы, она непосредственно влияет на изотермы адсорбции, а так как адсорбция — процесс экзотермический, снижение температуры способствует ее ускорению. Несмотря на это, температура в системах для культивирования водных организмов оказывает относительно незначительное воздействие на адсорбцию активным углем.
Многокомпонентные растворы. В воде систем для культивирования организмов содержатся различные растворенные вещества. Современный уровень знаний не позволяет установить, вступают ли содержащиеся в воде растворенные вещества в конкуренцию за участки адсорбции и каково их взаимовлияние при адсорбции. Несомненно, относительный размер молекул, адсорбционное сродство и относительные концентрации различных растворенных веществ оказывают влияние на адсорбцию всех растворенных веществ. Опыты Вебера и Морриса с детергентами (Weber and Morris, 1964) показали, что присутствие более чем одного растворенного вещества снижает адсорбцию каждого из них(, но увеличивает общую адсорбционную способность активного угля по сравнению с его адсорбционной способностью в отношении каждого отдельного растворенного вещества. К сожалению, такие данные для отработанных вод систем аквакультуры, по-видимому, отсутствуют.
Свойства адсорбента. Выше упоминался только активный уголь, но существует еще много других типов адсорбентов (летучая зола, глинозем и т. д.). Та небольшая информация, которая имеется по этим соединениям, относится к их использованию в системах очистки городских сточных вод, и применить эти данные непосредственно для культивирования водных организмов нельзя. Все другие адсорбенты, пожалуй, менее эффективны, чем активный уголь, по-видимому, из-за меньшей площади поверхности на единицу веса.
Типы угольных фильтров
Угольные фильтры могут быть периодического и непрерывного действия. Фильтр периодического действия представляет собой резервуар, заполненный активным углем. Бассейн заполняют отработанной водой. Часто для увеличения скорости адсорбции воду и уголь перемешивают и смеси дают отстояться. Затем очищенную воду отводят, а уголь либо выбрасывают, либо регенерируют. Такая система дает хорошие результаты при небольших объемах воды, но является трудоемкой и имеет ограниченную пропускную способность.
Контактные фильтры непрерывного действия можно разделить, по меньшей мере, на два типа. Первый, как и фильтр периодического действия, представляет собой бассейн с гранулированным углем, но отработанная вода непрерывно поступает с одного конца бассейна, проходит через уголь и вытекает из противоположного конца. Контактное время, таким образом, зависит от скорости потока и объема угольного слоя. Если вода в бассейн подается снизу вверх, это восходящий фильтр. В восходящих фильтрах применяют либо гранулированный, либо порошкообразный уголь. Поскольку при неподвижном слое порошкообразного угля потеря напора будет слишком большой, обычно применяют ожиженный слой. Ожижение позволяет использовать мелкозернистый уголь, обеспечивает большую площадь поверхности на единицу веса и улучшает адсорбцию. Кроме того, турбулентность в фильтре увеличивается, что также повышает скорость адсорбции.
В контактных фильтрах непрерывного действия второго типа порошкообразный уголь подают в поток отработанной воды. По истечении определенного контактного времени уголь с адсорбированными веществами отделяют от воды. При этом отпадает необходимость в больших контактных резервуарах, и такие фильтры часто используют в системе очистки городских сточных вод.
Кривые проскока через адсорбент
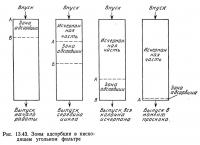
Адсорбция в колонне показана на рис. 13.43. Сначала адсорбция идет в зоне А—В. По мере насыщения верхней части зоны растворенным веществом зона постепенно смещается вниз, пока нижняя ее граница (Б) не достигнет дна колонны. Если после этого цикл продолжается, то верхняя граница зоны адсорбции приблизится к дну колонны, и глубина зоны существенно уменьшится. Сокращение зоны адсорбции приводит к уменьшению эффективности адсорбции и увеличению концентрации растворенного вещества в выходящей воде.
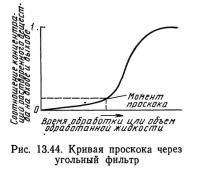
Угольные фильтры непрерывного действия рассчитываются на основании кривых проскока (рис. 13.44). В начале работы фильтра отношение концентрации растворенного вещества в выходящей воде к его концентрации в поступающей воде CeCi будет небольшим. В процессе работы фильтра концентрация медленно линейно возрастает. В определенный момент времени отношение Ce/Ci становится нелинейным и резко увеличивается. Это происходит, когда нижняя граница зоны адсорбции в нисходящем фильтре (см. рис. 13.43) достигает дна колонны. Сокращение зоны адсорбции со временем приводит к увеличению отношения Ce/Ci до тех пор, пока концентрация в выходящей воде станет равной концентрации во входящей воде, а весь уголь окажется насыщенным растворенным веществом. Точка проскока, показанная на рис. 13.44, — это тот момент, когда вода на выходе перестает отвечать предъявляемым к ее качеству требованиям. Поскольку требования к качеству воды зависят от ее назначения, положение точки непостоянно. Точка проскока обозначает момент, когда адсорбент следует заменить. Когда концентрация растворенного вещества в воде, выходящей из колонны, начинает превышать допустимую, считается, что произошел проскок через адсорбент.
Расчет угольного фильтра
Кривую проскока строят экспериментально с помощью лабораторной колонны и пробы подлежащей обработке сточной воды. Хотя это и вполне надежный метод, но в некоторых случаях лабораторные данные нельзя целиком распространить на промышленные угольные колонны. Адсорбция зависит от типа активного угля и размеров его частиц, от характеристик отработанной воды, вида контактирования воды и угля и скорости протекания воды. Поскольку адсорбция протекает в зоне, необходима соответствующая минимальная глубина фильтра. Как правило, при выборе угольного фильтра для конкретного применения проводят испытания на проскок с несколькими наиболее подходящими типами угольных фильтров. По изотермам адсорбции,'полученным от изготовителя, а еще лучше построенным экспериментально, и по кривой проскока можно рассчитать вес растворенного вещества, адсорбируемого на единицу веса угля. С увеличением скорости протекания жидкости эта величина может уменьшаться, поэтому кривые проскока целесообразно вычерчивать для различных скоростей. Определив адсорбционную способность при расчетных эксплуатационных условиях и тип угля, можно по кривым проскока вычислить время контакта с углем, размер резервуара и интервалы времени между заменами угля.
Вебер (1969) приводит подробную методику расчета фильтров с неподвижным слоем угля, хотя они и не предназначены специально для систем аквакультуры. Однако его методика в значительной степени опирается на графическое интегрирование кривой. Рассмотрение подхода Вебера выходит за рамки данной книги и более подробную информацию читатель может получить непосредственно из его работы.
Хатчинс (Hutchins, 1973) разработал методику расчета систем с активным углем,, в основу которой положен срок службы фильтрующего слоя. Этот метод основан на том, что зависимость срока службы (время от начала работы фильтра) от толщины слоя (глубина контактора) носит линейный характер.
где t — срок службы, ч; а — отрезок на оси t при x=0; b — наклон прямой линии; х — толщина слоя, м.
Отрезок а определяется из выражения
где К — постоянная скорости адсорбции (количество обработанной жидкости в м3 на 1 кг загрязняющего вещества, поступающего в систему за 1 ч), необходимой для перемещения фронта адсорбционной волны через слой, толщина которого равна зоне активной адсорбции (зона А—В на рис. 13.43); Ci — концентрация растворенного вещества в поступающей жидкости, мг/л, С0 — концентрация растворенного вещества в вытекающей жидкости в момент проскока, мг/л.
Наклон b в уравнении (13.37) определяется из уравнения
где N0 — эффективность угля, кг растворенного вещества на 1 м3 угля; Q — скорость потока, м3/(мин·м2); Ci — концентрация растворенного вещества в поступающей жидкости, мг/л.
Таким образом, подставив уравнения (13.38) и (13.39) в уравнение (13.37), получаем
Это уравнение и определяет срок службы слоя активного угля. Наклон b [уравнение (13.39)] — это срок службы (в ч) 1м угля в лабораторных условиях. Величина, обратная наклону, — это скорость насыщения угля растворенным веществом. Таким образом, величина, обратная наклону, умноженная на кажущийся объемный вес адсорбента, дает ориентировочный срок службы адсорбента.
Отрезок абсциссы — это критическая толщина слоя, т. е. минимальная толщина, необходимая для обеспечения требуемого качества воды в начале работы. Отрезок ординаты [уравнение (13.38)] — это скорость адсорбции, или время, необходимое для прохождения фронта волны адсорбции через слой критической толщины.
Угол наклона и длину отрезка в уравнении (13.40) можно получить с помощью опытной установки, обычно состоящей из трех угольных колонн. Глубина каждой колонны должна соответствовать глубине полногабаритной колонны. Скорость протекания на единицу площади поперечного сечения и качество воды на входе также должны быть идентичны тем, которые ожидаются в промышленной установке. По мере протекания отработанной воды через колонны пробы воды на входе в первую колонну и на выходе всех трех колонн отбирают и анализируют через равные промежутки времени. Строят график зависимости содержания растворенного в воде вещества от срока службы каждой колонны. Момент проскока можно определять для любого требуемого качества воды на выходе. Поскольку опытная установка состоит, по меньшей мере, из трех колонн, получится три точки. Затем для каждой колонны рассчитывают время до проскока и получают три значения продолжительности работы, соответствующие трем значениям эффективной толщине слоя. На графике зависимости продолжительности работы до проскока от толщины слоя вычерчивают кривую, которая должна быть прямолинейной, если скорость протекания жидкости, содержание и состав примесей оставались относительно постоянными во время опыта.
Найденную экспериментально кривую можно использовать для определения постоянных из уравнения (13.40). Изменение скорости протекания жидкости вызовет только изменение наклона кривой. Чтобы учесть изменение скорости в уравнении (13.40), наклон, т. е. уравнение (13.39), умножают на отношение новой скорости протекания жидкости к старой (Hutchins, 1973).
Влияние неодинаковой концентрации растворенного вещества в поступающей воде можно оценить также математически, хотя более надежные результаты дает проведение специальной серии испытаний. Изменение концентрации растворенного вещества в поступающей воде вызывает изменение наклона и длины отрезка в уравнении (13.40). Новый наклон можно оценить, умножив первоначальный наклон на отношение начальной концентрации к новой.
Несколько сложнее определить длину отрезка. Для этого можно взять уравнение (13.38) и выполнить следующие вычисления:
где а — длина первоначального отрезка; а' — длина нового отрезка; Cn — новая концентрация растворенного вещества на входе, мг/л; С0 — первоначальная концентрация растворенного вещества на входе, мг/л; Cn1 — новая концентрация растворенного вещества на выходе, мг/л; С01 — первоначальная концентрация растворенного вещества на выходе, мг/л.
Удаление вирусов
Показана возможность удаления некоторых вирусов адсорбцией на активном угле (Cookson, 1967; Cookson, 1970; Sproul et al., 1967). Куксон (1970) утверждает, что адсорбция вируса в колонне активного угля достаточно точно описывается теорией переноса масс. Выводы Куксона (1967, 1970) были основаны на удалении бактериофага Т4 вируса Escherichia coli. Исследования Куксона и Норта (Cookson and North, 1967) показали, что активный угол малоэффективен для адсорбции вируса. По их оценке, максимальная зона действия поверхности адсорбента составляла всего 18%, и из-за размера бактериофага Т4 Е. coli адсорбция в порах, по-видимому, не происходила. Эти результаты дают основание предполагать, что адсорбция на активном угле происходит в единичном слое и все участки угля обладают одинаковой адсорбционной способностью.
Адсорбция вируса зависит от его концентрации в растворе. Куксон и Норт (1967) показали, что адсорбция резко увеличивалась, когда концентрация бактериофага Т4 Е. coli возрастала до 3·107 экз./мл, но оставалась постоянной при увеличении концентрации.
Следует отметить, что эта величина, вероятно, будет меняться в зависимости от типа угля, вида вируса, размера частиц угля и других переменных. Куксон и Норт (1967) указывают, что адсорбцию вируса на активном угле можно представить изотермой Лангмюра.
Органическое вещество конкурирует с полиовирусом за участки адсорбции (Sproul et al., 1969). Если воду, содержащую органические примеси, пропустить через насыщенный вирусом фильтр, то органическое вещество вытеснит вирус, что приведет к высокой концентрации вируса в отфильтрованной воде. Обобщая информацию по адсорбции вирусов активным углем, Спроул и др. (1969) утверждают, что адсорбция действительно происходит (в лучшем случае можно рассчитывать на удаление 40%), но процесс не настолько надежен, чтобы на него можно было полагаться в отношении удаления вирусов при обработке отработанных вод.
Ионообмен
Электрохимический обмен ионами между двумя веществами (обычно между раствором и нерастворимым в растворе твердым веществом) называется ионообменом. Ионообмен — это явление не только поверхностной адсорбции, он затрагивает также и внутреннюю структуру трехмерных молекул. Таким образом, это процесс одновременно и адсорбционный, и абсорбционный, и его лучше всего назвать сорбцией.
Ионообменные смолы можно разделить на четыре группы: сильнокислые катионы, слабокислые катионы, сильноосновные анионы и слабоосновные анионы. Эта классификация основана на способе изготовления, а также на свойствах материала. Кроме того, существует множество естественных ионообменных материалов, таких, как глины и цеолиты. Выбор соответствующей смолы для сорбции конкретного соединения зависит от свойств соединения. Обычно необходимые сведения можно получить у изготовителя смол.
В качестве примера ионообменного процесса рассмотрим умягчение воды. Жесткость воды обусловлена присутствием в ней кальция и магния. Эти элементы можно удалить с помощью натриевого цеолита:
где Z — цеолит, или твердая фаза в ионообменной системе.
При прохождении жесткой воды через цеолит ионы натрия высвобождаются и замещаются ионами кальция. Вода на входе содержит главным образом ионы Са2+ или Mg2+), а на выходе — ионы Na+, которые не придают воде жесткости. На каждый удаляемый цеолитом ион кальция высвобождается два иона натрия. Этот обмен двух ионов на один является результатом необходимости сохранить электрическую нейтральность цеолита и раствора. Кальций двухвалентен, натрий одновалентен.
Уравнение (13.42) представляет обменную реакцию только для одного типа ионообмена. Другие ионообменные процессы осуществляются путем аналогичных реакций, хотя в них участвуют другие ионы. Катионообменные процессы идут в основном с участием металлов, а анионообменные удаляют такие анионы, как сульфиды, фториды и бикарбонаты.
Ионообмен происходит в определенной последовательности. Для синтетических смол Фэйер и др. (Fair et al., 1968) приводят следующие ряды ионов в порядке увеличения сродства:
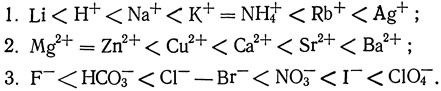
Двухвалентные ионы имеют более высокое сродство к ионообменным смолам, чем одновалентные.
Существуют также смолы, называемые селективными ионообменными смолами и созданные специально для сорбции определенных ионов, например NH+4. Для этих смол характерна весьма высокая избирательность по отношению к тем ионам, для удаления которых из раствора они предназначены.
Ионообмен можно использовать для удаления из сточных вод ионов аммония. В водных растворах аммиак (NH3) находится в равновесии с аммонием (NH+4), причем относительное содержание каждой формы зависит от pH системы. Неионизированная форма (NH3) высокотоксична для культивируемых водных организмов. Удаление NH+4 снижает также и содержание NH3 из-за реакции равновесия.
Для удаления аммиака из городских стоков используют клиноптилолит — природный цеолит (Culp, 1974) и сильнокислые катионообменные смолы натриевой формы (Spotte, 1974). Удаление 93—97% аммиака клиноптилолитом на опытной очистной установке производительностью 378 м3 в день было продемонстрировано Мерсером и др. (Mercer et al., 1970). Джонсон и Сиберт (Johnson and Sieburth, 1974) показали, что при содержании в воде растворенного органического и другого вещества, равном 30 Mjj/л, момент проскока сдвинулся с 35 до 10 л поступавшего на обработку в клиноптилолитовую колонну стока. Кроме того, органическое вещество, по-видимому, препятствует регенерации клиноптилолита. После регенерации эффективность колонны, через которую ранее проходило органическое вещество, была вдвое ниже эффективности колонны, через которую до регенерации проходила только дистиллированная вода и аммиак (Johnson and Sieburth, 1974).
Органическое вещество, содержащееся в поступающей воде, блокирует ионообменный слой, что увеличивает потерю напора (Kunin, 1950). Кроме того, она закрывает ионообменный субстрат, препятствует обмену ионов жидкой и твердой фаз. Это уменьшение обменной способности сокращает интервалы времени между циклами регенерации и увеличивает продолжительность цикла регенерации и периода промывки (Arden, 1968).
Очистку смол можно осуществить отмачиванием в течение 12—24 ч в смеси рассола и гипохлорита, содержащей около 2 % активного хлора (Arden, 1968). В результате темное органическое вещество осветляется и количество его уменьшается, но, по всей видимости, полная очистка не происходит. Кроме того, гипохлорит разрушает некоторые смолы и может привести к значительному снижению обменной способности смолы, если такая обработка производится периодически в течение более 2—3 лет (Arden, 1968).
Арден (1968) рекомендует пропускать через ионообменный слой тонкими струями в течение 1—2 ч раствор 10%-ной NaCl и 1%-ного NaOH в объеме, равном полутора объемам слоя. Желательно предварительное отмачивание слоя в течение ночи. Такая обработка удаляет большую часть органических веществ и восстанавливает ионообменную способность почти до первоначального состояния.
Джонсон и Сиберт (1974) проводили также опыты по ионообмену в искусственной морской воде соленостью 5, 10, 15 и 25‰, как содержавшей, так и не содержавшей растворенное органическое вещество. Эффективность удаления аммиака смолой AW-500 в воде соленостью 5‰ снижалась в 10 раз. Более высокая соленость вызывала дальнейшее уменьшение эффективности, но не столь значительное. Аналогичные результаты наблюдались и в случае применения клиноптилолита. Высокие концентрации различных ионов в морской воде приводят к быстрому насыщению ионообменных смол. Спотт (Spotte, 1970) и Джонсон и Сиберт (1974) пришли к выводу, что ионообмен не годится для удаления аммиака из морских систем. Такого же мнения придерживается и автор (Wheaton, 1975). Спотт/(1970) указывает, что ионообмен пригоден для удаления нитратов и фосфатов из пресноводных систем, но не морских из-за высокого содержания в них ионов. К ионообменным смолам предъявляются следующие требования: большая площадь для ионообмена; регенерация недорогими материалами (например, NaCl); нерастворимость в экстрагируемом растворе и поглощение достаточного количества воды для обеспечения свободного проникания молекул растворенного вещества в частицы цеолита.
Существующие материалы в разной степени удовлетворяют этим требованиям. Почти все синтетические ионообменные цеолиты — это полистиролы с поперечными связями, к которым присоединены различные молекулярные структуры для придания материалу соответствующих свойств. Существуют также природные материалы, обладающие ионообменными свойствами; к их числу относятся глины, глауконитовый песок и клиноптилолит.
Ионообмен находит применение при очистке пресных вод, использованных для выращивания гидробионтов. Изучалось удаление с помощью ионообмена аммония, нитрата и фосфата (Nesbitt, 1969). По-видимому, это реально, особенно для аммония. Удаление ионообменом некоторых органических кислот также, по-видимому, целесообразно. Из-за присутствия самых разнообразных ионов и их высокой концентрации в соленой воде обменные участки твердой фазы заполняются настолько быстро, что ионообмен, по-видимому, нецелесообразно применять в солоноводных и солоноватоводных (3—5 мг/л и выше) системах для культивирования организмов. Относительно большое количество органического вещества, обычно присутствующее в отработанных водах таких систем, необходимо значительно уменьшить (а иногда и полностью удалить) до ионообменной обработки. В противном случае ионообменная способность слоя снизится и потребуется частая очистка для удаления органического материала с ионообменного слоя.
При попытках восстановить отработанные культуральные воды следует учитывать характер обменного процесса. Некоторые ионы экстрагируются, другие высвобождаются. Поскольку высвобожденные ионы могут оказаться токсичными для культивируемых организмов, следует с большой осторожностью подходить к выбору ионообменной смолы и режиму работы ионообменника.
Момент проскока через ионообменный слой зависит от характеристик отработанной воды (например, содержание твердого и органического вещества), скорости потока, типа смолы, объема обменного слоя и обменной способности. Для определения моментов проскока лучше всего провести эксперименты с учетом всех факторов. Обрастание водорослями и микробами также может уменьшить скорость обмена и обменную способность.
Пенное фракционирование
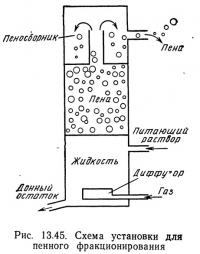
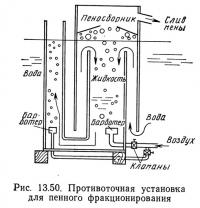
Процесс сепарации или концентрации растворенных веществ адсорбцией одного или нескольких растворенных веществ на поверхности пузырьков называется пенным фракционированием. В процессе адсорбции растворенное вещество концентрируется на по-вещество концентрируется на поной, образованной пузырьками над поверхностью жидкости, удаляется и сконцентрированное растворенное вещество. На рис. 13.45 показано принципиальное устройство пеноотделительной колонки. Питающий раствор, содержащий растворенное вещество и растворитель, закачивают в цилиндрическую колонну. В нижнюю часть колонны через диффузор подают газ (обычно воздух), который образует мелкие пузырьки. Пузырьки поднимаются к поверхности жидкости и при этом собирают на своей поверхности растворенное вещество.
На поверхности жидкости образуется пена, содержащая растворенное вещество и небольшое количество растворителя. По мере накопления пена попадает в камеру — коллектор и затем отводится. «Чистый» растворитель, т. е. донный остаток с пониженным содержанием растворенного вещества, выводится из нижней части колонны. Уровень жидкости в колонне регулируется с помощью клапана в нижней части колонны; можно также подсоединить к выводному отверстию шланг или трубу и поднимать ее конец до тех пор, пока уровень жидкости не достигнет требуемой отметки.
Существует несколько способов разделения, сходных с пенным фракционированием, некоторые из которых могут найти применение в хозяйствах аквакультуры. Не останавливаясь на них подробно, отметим лишь их особенности. Пузырьковое фракционирование аналогично пенному, за исключением того, что при этом способе пена не образуется. Этот процесс идет в присутствии поверхностно-активного вещества, но по разным причинам пена не образуется. Поскольку раствор вблизи поверхности жидкости обогащается растворенным веществом, медленное удаление поверхностной жидкости снижает содержание растворенного вещества в донном остатке.
Флотация, используемая при удалении отходов, очистке руды и концентрировании микроорганизмов, весьма сходна с пенным фракционированием. Процесс заключается в барботировании воздуха в смесь жидкости и твердого вещества и присоединении пузырьков к твердому веществу до тех пор, пока удельный вес системы твердое вещество — пузырек не станет меньше удельного веса воды и она не всплывет на поверхность.
Пенное фракционирование используется для разделения или очистки различных материалов. Рубин и Гейден (Rubin and Gaden, 1962) приводят список 92 элементов и соединений, которые очищают, концентрируют или разделяют с помощью пенного фракционирования. Важно отметить, что в этот список вошли некоторые ионы, встречающиеся в морской воде (например, кальций, медь, магний, марганец). Некоторые исследователи использовали пенное фракционирование для удаления растворенного органического вещества из воды, в которой содержалась рыба или беспозвоночные (Dwivedy, 1973; Spotte, 1970; Wheaton, 1973; Lomax and Wheaton, 1975). Удаление органических веществ из такой воды уменьшает образование аммиака путем извлечения исходных белковых веществ до их разложения под влиянием бактерий (Dwivedy, 1973). Таким образом, пенное фракционирование уменьшает БПК, ХПК1 и накопление нитратов в воде, в которой содержались культивируемые организмы (Dwivedy, 1973; Lomax, 1976). Поскольку с помощью пенного фракционирования удаляют растворенные органические вещества, в том числе и органические кислоты, оно позволяет контролировать pH среды (Dwivedy, 1973).
Пенное фракционирование пригодно для удаления поверхностно-активных растворенных веществ или растворенных веществ, которые можно сделать поверхностно-активными добавлением соответствующего вещества, вызывающего образование внутрикомплексных соединений. Поскольку пенное фракционирование более эффективно при низких концентрациях растворенного вещества, его используют главным образом для концентрирования и выделения растворенных веществ из разбавленных, растворов. Его применяют также для концентрирования или разделения ферментов, белков и других биологических веществ, чувствительных к температуре, изменениям pH, растворителям и другим факторам. Однако некоторые белки на границе раздела жидкость — газ, по-видимому, денатурируют (Schnepf and Gaden, 1959).
Теоретические основы
Адсорбция на границе раздела фаз описывается уравнением Гиббса в общем виде
где Г — поверхностная избыточная концентрация, г·моль/см2; а — активность растворенного вещества, г·моль/см3; R — универсальная газовая постоянная, 8,48·106 г/(с2·моль·К); Т — абсолютная температура, К; γ — поверхностное натяжение, г/с2.
В литературе это уравнение встречается в разных видах в зависимости от допущений и конкретных условий. Обзор этих уравнений дан в работе Рубина и Гейдена (1962). Однако пенное фракционирование обычно применяют для сильно разбавленных растворов, а при этих условиях активность можно аппроксимировать концентрацией — параметром, который легко определить, поэтому уравнение (13.43) обычно записывают в виде
где С — концентрация, г·моль/см3.
Еще более удобный вид уравнение (13.44) принимает, если его записать в виде уравнения (13.45), которое применимо для неионного поверхностно-активного вещества в водном растворе при концентрациях ниже критической мицеллярной. Критическая мицеллярная концентрация — это концентрация, выше которой поверхностно-активное вещество находится не в виде определенных молекул, а в агрегированном состоянии:
Таким образом, если построить график, на одну ось которого нанести поверхностное натяжение у, а на другую натуральный логарифм концентрации С, то наклон линии будет равен 1/RTГ. Поскольку R и Т известны, можно определить Г. Если поверхностно-активное вещество находится в водном растворе при низких концентрациях, адсорбцию можно рассматривать как моно-слой поверхностно-активного вещества на поверхности пузырьков. Если это так, то Г можно аппроксимировать выражением 3·10-10 г·моль/см2. Лаш (Lush, 1976), работавший с расширяющимися водными растворами детергента Тритон Х-100, обнаружил, что Г=2,3·10-10 г·моль/см2, что близко к величине ЗХ10-10 г·моль/см2.
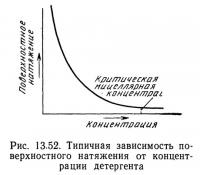
Критическую мицеллярную концентрацию (КМК) можно также определить как концентрацию, при которой наклон графика, характеризующего зависимость поверхностного натяжения от логарифма концентрации, резко возрастает (обычно отрицательно). В физическом смысле это момент, когда межфазовая площадь (т. е. площадь поверхности раздела между двумя фазами) оказывается насыщенной и добавление растворенного вещества приводит к агрегированию его молекул (т. е. образованию мицелл) в объемном растворе. Поскольку поверхность между фазами уже насыщена, добавление растворенного вещества сверх КМК не оказывает существенного влияния на поверхностное натяжение.
Рабочий режим
Установки для пенного фракционирования разнообразны по форме, но работают по одному из четырех основных рабочих режимов. Первый из них (см. рис. 13.45) называют простым режимом: питающий раствор поступает ниже уровня жидкости, пену удаляют сверху, а «чистую» жидкость — снизу.
Идеальная работа установки для пенного фракционирования описывается следующими уравнениями (Lemlich, 1968):
где С0 — концентрация растворенного вещества в пене, г·моль/см3; Cb — концентрация растворенного вещества в донном остатке, г·моль/см3; G — скорость потока газа, см3/с; Гb — поверхностная избыточная концентрация растворенного вещества на пузырьках в условиях равновесия с концентрацией в донном остатке, г·моль/см2; Q0 — скорость потока безгазовой пены, см3/с; S — отношение поверхности пузырька к его объему, см-1.
где Cf — концентрация раствюренного вещества в питающем растворе, г·моль/см3; Qf — объемная скорость потока питающего раствора, см3/с.
Уравнения (13.46) и (13.47) будут приблизительно описывать работу установки для пенного фракционирования, если отверстие для впуска воздуха достаточно заглублено (в большинстве случаев достаточным считается 30—60 см), а слипание пузырьков в колонне пренебрежимо мало (Lemlich, 1968). Слипание пузырьков и другие отклонения от идеальных условий снижают эффективность работы.
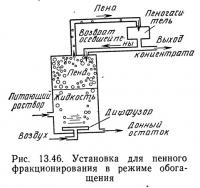
Второй режим работы установки пенного фракционирования (рис. 13.46) часто называют режимом обогащения, так как часть осевшей пены вновь поступает в колонну и проходит сквозь образующуюся пену. Благодаря этому концентрация растворенного вещества в пене увеличивается, так как осевшая и более концентрированная пена замещает жидкость, окружающую пузырьки. Идеальная работа установки для пенного фракционирования в режиме обогащения описывается следующим уравнением:
где С0l — объемный поток пены (в виде жидкости), возвращаемый в колонну, см3/с.
Сравнение уравнений (13.46) с (13.48) и (13.47) с (13.49) показывает, что режим обогащения увеличивает концентрацию растворенного вещества в пене, но не оказывает влияния на его концентрацию в донном остатке.
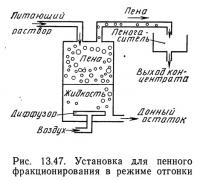
Третий режим работы, называемый режимом отгонки, показан на рис. 13.47. Патрубок подачи питающего раствора расположен значительно выше поверхности раздела жидкость—пена, и раствор стекает по пене. При этом питающий раствор «омывает» воду, выносимую вверх с пеной, до тех пор, пока концентрация в ней не достигнет концентрации в питающем растворе. Идеальные условия работы установки в режиме отгонки описываются следующими уравнениями (Lemlich, 1968):
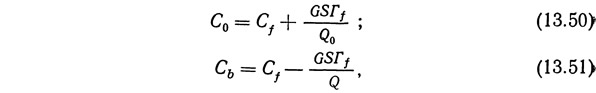
где Гf — поверхностная избыточная концентрация в условиях равновесия с питающим раствором, г·моль/см2; Q — скорость потока донного остатка (отстоя), см3/с.
Режим отгонки очищает донный остаток (т. е. снижает концентрацию растворенного вещества в отстое).
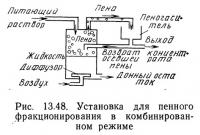
Поскольку часто требуется, чтобы концентрация растворенного вещества была максимально высокой в пене и низкой в донном остатке, режимы обогащения и отгонки объединяют и такой режим называют комбинированным (рис. 13.48). Идеальные условия работы описываются следующими уравнениями (Lemlich, 1968):
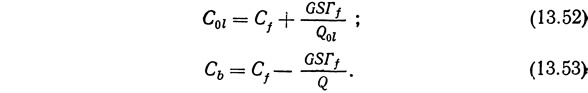
По сравнению с простым комбинированный режим дает обогащенную пену и обеспечивает более низкую концентрацию растворенного вещества в донном остатке.
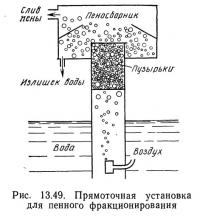
Кроме рассмотренных выше четырех режимов работы по другой системе классификации (Spotte, 1970) существует прямоточное и противоточное пенное фракционирование. Установка для прямоточного фракционирования (рис. 13.49) напоминает эрлифт, так как воздух подается в нижнюю часть колонны и вместе с водой поднимается вверх. В противоточной установке (рис. 13.50) вода направляется вниз, а воздух идет вверх. Воздух и вода движутся в противоположных направлениях, что увеличивает продолжительность контакта между ними и эффективность установки.
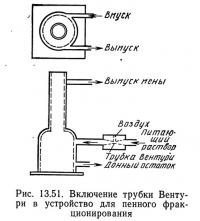
Еще одна конструкция установки для пенного фракционирования (рис. 13.51) имеет наружную трубку Вентури или насадку, через которую воздух подается в воду, затем смесь воздуха и воды нагнетается в колонну. В такой установке необходим только насос для воды и сужение (т. е. трубка Вентури, сопло, насадка и т. п.), которое обеспечивало бы снижение атмосферного давления. Воздух в систему поступает для насоса, но необходимо некоторое падение давления в водоподающем трубопроводе. Соотношение воздуха и воды зависит от вида сужения и соотношения давлений в нем, а также от скорости потока воды.
Факторы, влияющие на эффективность работы установки
Параметры, влияющие на работу установки для пенного фракционирования, можно разделить на основные и второстепенные. К основным переменным относятся: вид вещества, используемого в качестве растворителя, газа и растворенного вещества; концентрация растворенного вещества, скорость потока газа; pH; температура; высота и диаметр колонны, заглубление впускного патрубка, режим работы и способ подачи воздуха. К второстепенным переменным относятся: растворимость растворенного вещества; поверхностное натяжение; вязкость; равновесное соотношение; кинетика адсорбции; свойства пены и пузырьков.
Основные переменные. Характер химических веществ, используемых в установке, определяет поверхностную активность растворенного вещества и пенообразующую способность раствора. Свойства пены зависят от растворенного вещества, растворителя и газа. При фракционировании воды, в которой содержались культивируемые организмы, растворителем является вода, а газом — воздух. Растворенным веществом в этих водах могут быть белки, спирты, органические кислоты и т. п., а также такие неорганические вещества, как аммиак, фосфат, сульфаты и кальциевые соединения. Если в системах для культивирования используется морская вода, то соли вносят в раствор многочисленные неорганические ионы.
При удалении с помощью пенного фракционирования загрязнений необходимо, чтобы удаляемое растворенное вещество было поверхностно-активным или чтобы его можно было сделать поверхностно-активным добавлением соответствующего соединения. Пена должна быть достаточно стойкой, чтобы ее можно было удалить до оседания. Соединения, не обладающие поверхностной активностью, можно удалить с помощью фракционирования, если они вступают в химическую реакцию с образованием поверхностно-активного соединения или если они электростатически притягиваются к поверхности поверхностно-активного вещества. С помощью пенного фракционирования удаляются главным образом растворенные вещества, хотя в результате электростатического притяжения частиц к поверхности пузырьков или физического их захвата пеной может быть удалена и часть твердых примесей.
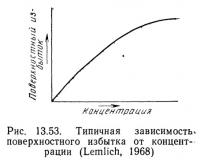
Значительное влияние на работу установки для пенного фракционирования оказывает концентрация растворенного вещества. Поскольку поверхностное натяжение часто логарифмически зависит от концентрации, изменения концентрации растворенного вещества (особенно при низких концентрациях) быстро снижают поверхностное натяжение. Это вызывает изменение поверхностной избыточной концентрации и пенообразующих характеристик раствора. На рис. 13.52 показана типичная зависимость между поверхностным натяжением и концентрацией, а на рис. 13.53 — между поверхностной избыточной концентрацией и концентрацией. Формы приведенных кривых типичны, но кривые, описывающие эти зависимости, могут иметь и другую форму. Пенное фракционирование дает наилучшие результаты при низких концентрациях, особенно при концентрациях ниже КМК.
Максимальная экстракция белков достигается при изоэлектрическом значении pH экстрагируемого белка (Rubjin and Gaden, 1962). Поскольку разные белки имеют различные изоэлектрические значения pH, удаление белков из воды, в которой содержались культивируемые объекты, может привести к предпочтительной экстракции определенных белков. Чтобы определить вероятность, экстракции отдельных белков, необходимо знать их изоэлектрические точки и pH воды.
Скорость потока газа влияет на площадь поверхности, доступной для адсорбции. Увеличение скорости потока газа увеличивает площадь поверхности до тех пор, пока при значениях скорости выше той, при которой образуется поверхность, пузырьки в заполненной жидкостью части колонны не начнут слипаться.- Дальнейшее увеличение скорости потока газа лишь увеличит затраты на нагнетание воздуха с большей скоростью, но не повысит интенсивности экстракции. Вместе с тем увеличение скорости потока газа увеличивает скорость и уменьшает время стенания пены. Плотность пены увеличивается благодаря большему захвату жидкости. По той же причине уменьшается коэффициент обогащения (т. е. концентрация растворенного вещества в пене, деленная на концентрацию растворенного вещества в питающем растворе). По-видимому, в большинстве случаев превалирует последнее явление, так как коэффициент обогащения снижается с увеличением скорости потока газа. На скорость потока газа влияет также режим впуска: чем мельче пузырьки, тем больше отношение площади поверхности к объему. Размер пузырьков определяется размером впускного отверстия, свойствами раствора и степенью*' слипания пузырьков. В идеале все пузырьки должны иметь одинаковый размер и быть равномерно распределены в жидкости. На практике таких идеальных условий не бывает, но правильный расчет и регулирование скорости потока газа может обеспечить достаточное приближение к ним.
Температура частично определяет вязкость жидкости и поверхностное натяжение. Увеличение вязкости снижает скорость стекания пены и делает ее более сырой, а также снижает скорость подъема пузырьков через жидкость, хотя при температурах, наблюдаемых в системах аквакультуры, это имеет лишь второстепенное значение. Некоторые поверхностно-активные вещества не вспениваются или обладают пониженной вспениваемостью при всех температурах, кроме определенного диапазона, свойственного данному соединению, поэтому изменением температуры можно иногда разделить два или несколько веществ, растворенных в одном растворителе. Для большинства соединений оптимальную температуру следует определять экспериментально (Rubin and Gaden, 1962).
Физические характеристики установки также влияют на ее работу. Влияние различных режимов работы на эксплуатационные параметры было рассмотрено выше. Увеличение высоты колонны способствует получению более сухой пены с повышенной концентрацией растворенного вещества при условии, что все остальные параметры остаются постоянными. Коун (Kown, 1971) показал, что при высоте свыше 30 см работа колонны при низких скоростях потока газа не улучшалась. В высоких колоннах слив пены происходит медленнее и пена более сухая, особенно при высоких скоростях газа. Диаметр колонны также влияет на ее работу. Коун (1971) также показал, что увеличение диаметра колонны (при остальных неизменных параметрах) уменьшало общую эффективность, поверхностную избыточную концентрацию и коэффициент обогащения. Этого следовало ожидать, так как с увеличением диаметра площадь поверхности на единицу объема в колонне уменьшалась (так как поток газа оставался постоянным). Для обеспечения высокой эффективности фракционирования необходима равномерная подача воздуха.
Второстепенные переменные. Низкая растворимость вещества способствует повышению эффективности установки. Создается впечатление, что чем менее растворимо вещество, тем быстрее и полнее оно перемещается к поверхности раздела фаз. Это вызывает увеличение концентрации поверхностно-активного вещества на поверхности раздела и ускоряет экстракцию.
Поверхностное натяжение также влияет на образование и оседание пузырьков. Влияние вязкости рассматривалось выше.
Здесь необходимо принимать во внимание два равновесных отношения: химическое равновесие между растворенными веществами и между растворителем и растворенными веществами; равновесие между концентрацией растворенного вещества в жидкости пены и его концентрацией в объеме раствора. В объеме раствора и на поверхности раздела газ — жидкость химическое равновесие неодинаково (Rubin and Gaden, 1962). Второе равновесие измеряют разными способами и выражают в концентрациях, коэффициентах обогащения и коэффициентах распределения. Рубин и Гейден (1962) отмечают, что в системах, содержащих только поверхностно-активные растворенные вещества, равновесные коэффициенты обогащения колеблются от 1 до 5, тогда как при разделении ионов металлов этот коэффициент может достигать 100.
Кинетика адсорбции также влияет на характеристики вспенивания. Уравнение Гиббса применимо только тогда, когда на поверхности раздела достигнуто равновесие. Однако поверхностное натяжение и, следовательно, поверхностная адсорбция могут со временем изменяться. По-видимому, существует два типа этого явления — быстрое и медленное поверхностное старение. При быстром поверхностном старении равновесие достигается в пределах доли секунды. В случае медленного поверхностного старения равновесие может не достигаться в течение нескольких часов и даже дней. Большинство исследователей; считают, что причиной этого является, не диффузия. Этот факт еще не получил удовлетворительного объяснения (Rubin and Gaden, 1962).
Расчет установки
Для расчета пенной установки важными факторами являются концентрация в донном остатке (вытекающей воде) и сухость (или объем) пены. Для процесса концентрирования важным фактором является также концентрация растворенного вещества в. пене. Концентрация в донном остатке является показателем чистоты вытекающей воды. Сухость пены важна потому, что удаление больших объемов осевшей пены может быть затруднительным.
Гривс и Бхаттачария (Grieves and Bhattacharyya, 1965) вывели два расчетных уравнения. Одно устанавливает зависимость между изменением концентрации и рабочими параметрами, а второе между скоростью потока пены и рабочими параметрами:
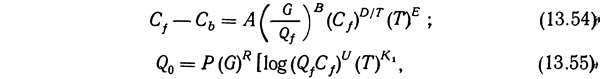
где Cf — концентрация в питающей жидкости, мг/мл; Cb — концентрация в донном остатке, мг/мл; G — скорость потока газа, мл/мин при нормальной температуре и давлении; Qf — скорость питающей жидкости, мл/мин; Т — температура, °F; Qf — скорость потока пены, мл/мин; A, B, D, E, P, R, U, К1 — постоянные.
Хотя уравнения (13.54) и (13.55) полезны, но постоянные зависят от вида растворенного вещества и используемой системы.. Не зная этих констант, трудно применять эти уравнения для расчета.
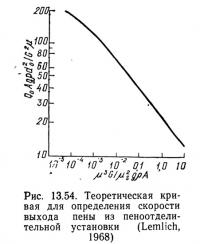
Лемлих (Lemlich, 1968) применяет другую методику расчета.. Его система основана на логарифмической зависимости (рис.. 13.54) между Q0Agρd20/G2/μ и μ3G/μ2sgρA (Q0 — скорость потока пены, см3/с; А — горизонтальное поперечное сечение колонны,. см2; g — ускорение силы тяжести, см/с2; ρ — плотность жидкости, г/см3; d0 — средний диаметр пузырька, см [см. уравнение (13.56)]; G — скорость потока газа, см3/с; μ — вязкость, г/(см·с); μs — поверхностная вязкость, г/с).
Средний диаметр пузырька (Lemlich, 1968)
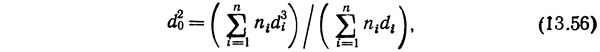
где ni — число пузырьков диаметром di в пробе пены (при слипании пузырьков пробу следует отбирать в верхней части колонны).
Поверхностную вязкость μs можно рассматривать как сопротивление натяжению на поверхности жидкости. Поверхностную вязкость лучше всего определять опытным путем. Для большинства поверхностно-активных веществ в воде комнатной температуры μs=10-4 дин·с/см, или 10-4 г/с.
Если μs для данной установки найдена, все значения двух параметров приведенного на рис. 13.54 графика известны, за исключением скорости потока пены Q0, которую теперь можно вычислить. Таким образом, рис. 13.54 можно использовать для оценки скорости потока пены при различных скоростях потока газа и площадях поперечного сечения колонны. Методом проб и ошибок можно добиться приемлемого соотношения Q0, А и G.
Концентрацию донного остатка и пены можно оценить с помощью уравнений (13.46)—(13.53). Однако прежде необходимо знать поверхностную избыточную концентрацию Г. Для особого случая, когда неионное поверхностно-активное вещество содержится в водном растворе при концентрациях ниже критической мицеллярной концентрации поверхностную избыточную концентрацию можно определить по уравнению (13.44) и графику зависимости поверхностного натяжения от концентрации. Часто считают, что основные поверхностно-активные вещества находятся в виде монослоя на границе фаз. В таком случае Г относительно постоянна и равна 3·10-10 г·моль/см2. Это неверно для следов ионов и для случаев удаления второстепенного поверхностно-активного вещества с помощью основного (Lemlich, 1968).
Трудности, связанные с использованием описанной выше методики расчета, дают повод для размышления. Использование уравнений (13.54) и (13.55) требует определения всех основных констант, а для этого необходимо проводить лабораторные эксперименты. Чтобы использовать методику Лемлиха (Lemlich, 1968), необходимо знать размер пузырьков [уравнение (13.56)]. Для этого следует провести серию лабораторных опытов на самой установке или на ее модели. Размер пузырьков пены можно определить так: быстро заморозить пену углекислым газом, сделать срез и измерить диаметр пузырьков либо сфотографировать работающую колонну и определить размер пузырьков по фотоснимкам. К сожалению, пузырьки у вертикальной стенки колонны, т. е. именно те, которые видны на фотоснимках, не типичны для пузырьков внутри колонны из-за эффекта стенки. Кроме того, при использовании методики Лемлиха (1968) необходимо определять значение поверхностной избыточной концентрации. Во многих случаях эту величину можно считать постоянной. Когда же этого сделать нельзя, для получения кривой зависимости поверхностной избыточной концентрации от концентрации необходимо провести серию лабораторных испытаний. Необходимо также помнить, что уравнение Гиббса верно только для условий равновесия, а во многих установках равновесие может и не достигаться.
Пенное фракционирование в системах аквакультуры
Установки для пенного фракционирования применяются во многих системах культивирования (Dwivedy, 1973; Wheaton, 1975; Lush, 1976; Lomax, 1976; Spotte, 1970). Двиведи ((Dwivedy, 1973) вывел уравнение для описания количества азота, остающегося в искусственной морской воде после работы установки пенного фракционирования в течение времени t:
где N — общий азот, остающийся в воде после фракционирования в течение времени t мг/л; Ni — начальная концентрация общего азота в начале работы установки, мг/л; t — время, ч.
Поскольку в системе, с которой работал Двиведи, вода совершала в час 7,5 оборотов, уравнение (13.57) можно использовать для любой установки пенного фракционирования путем подстановки 7,5 to вместо t [t0 — число оборотов воды (Dwivedy, 1973)].
Содержание общего азота в системе составило приблизительно 6 мг/л, а ХПК и ВПК— около 10 мг/л (Dwivedy, 1967).
Двиведи (1973) также показал, что при пенном фракционировании в системе поддерживалось более высокое значение pH, чем то, которое наблюдалось в контрольной системе без пенного фракционирования. Это объясняется тем, что при пенном фракционировании органические кислоты или исходное органическое вещество удаляется до образования органических кислот2. pH контрольной среды составлял в среднем около 7, а в бассейне с установкой для пенного фракционирования pH составлял в среднем 7,7—7,9. Следует иметь в виду, что в системах, с которыми работал Двиведи, живые организмы не содержались, а концентрация органических примесей обеспечивалась внесением мертвых устриц или смеси устричного мяса.
Для максимального удаления органического вещества потребовалось около 15 оборотов воды через установку независимо от его первоначальной концентрации (Dwivedy, 1973).
Во всех экспериментах Двиведи концентрация аммиака была низкой. Это объясняется не непосредственным удалением аммиака с помощью установки, а, по-видимому, удалением самих нитрифицирующих бактерий (так как в результате такой обработки происходит снижение ВПК и ХПК). Однако предварительные эксперименты Лоусона и Уитона (Lawson and Wheaton, 1975) показали, что пенное фракционирование способно и непосредственно уменьшать концентрацию аммиака. К сожалению, в этих экспериментах не удалось выяснить, каким образом был удален аммиак—аэрацией или пенным фракционированием.
Двиведи (1973) также показал, что в его установке с трубкой Вентури общее число бактерий в экспериментальном бассейне снижалось за 2,5 ч с 22100 до 220 в 1 мл, тогда как в контроле число бактерий на 1 мл увеличилось с 28150 до 29100. Чашечный подсчет в конце эксперимента показал присутствие в концентрированной пене бактерий в количестве 1115772 в 1 мл.
Пенное фракционирование дает хорошие результаты в солоноватоводных системах, но применимо и в пресноводных в присутствии относительно высоких концентраций органических веществ. Есть основания предполагать, что с помощью пенного фракционирования можно удалять некоторые микроэлементы из соленой воды. Эта проблема требует дальнейших исследований.
Примечания
1. БПК — биохимическое потребление кислорода; ХПК — химическое потребление кислорода, которое определяется по количеству израсходованного раствора КМп04 и называется перманганатной окисляемостью.
2. При пенном фракционировании увеличение pH происходит в результате удаления CO2 вместе с пузырьками воздуха. Сходный эффект наблюдается при барботаже и работе эрлифта.