Азот
Азот, попадая в водную среду из атмосферы, совершает сложный круговорот (рис. 6.1). В этом круговороте участвуют несколько химических форм азота и биологические системы различных типов. Азот в свободном состоянии попадает в воду либо из атмосферы, либо образуется в результате бактериальной денитрификации нитратов. Свободный азот довольно инертен и может потребляться лишь некоторыми видами бактерий и водорослей. Растворимость его в пресной воде обратно пропорциональна температуре и солености и прямо пропорциональна давлению.
Другие формы азота попадают в природные пресноводные системы из внешних источников или находятся в связанном состоянии в самих водоемах, однако количество такого связанного азота в настоящее время не известно. К внешним источникам относятся дожди, поверхностный сток, подземные воды и биологические реакции. С дождевой водой азот поступает в водные системы в виде аммиака и нитратов. В водах поверхностного стока содержатся различные формы азота: нитраты, соединения аммиака, нитриты и свободный азот. В водную среду попадают также нитраты, входящие в состав искусственных неорганических и органических удобрений и сточных вод. Подземные воды поглощают соединения азота, проникающие через почву. Источником азотных соединений является также происходящее в водных системах разложение биологических организмов. Кроме того, некоторые организмы выделяют в воду азотсодержащие соединения.
Органические соединения азота, обнаруживаемые в естественных водоемах, образуются в результате поглощения организмами азота, необходимого для построения тканей и протекания жизненно важных процессов. К таким органическим соединениям азота относятся азотно-углеродные соединения, белки растений и животных, мочевина и мочевая кислота, выделяемая животными. Обычно 50% или более растворенного азота в отфильтрованной и центрифугированной озерной воде имеет органическое происхождение. От 60 до 80% этого органического азота представляют собой такие аминосоединения, как аминокислоты, полипептиды и белки (Reid, 1961). В основном эти органические соединения азота образуются при разложении мертвых растений и животных. Однако некоторые виды синезеленых водорослей выделяют органические соединения азота в процессе своей жизнедеятельности, при этом в водную среду поступают такие экстрацеллюлярные азотные вещества, как полипептиды, амиды и аминокислоты.
Содержание органических азотных веществ в большинстве озер зависит от сезона и обусловлено различными факторами, однако, как правило, весной или в начале лета оно выше, чем в другие сезоны, поскольку основное цветение фитопланктона происходит в более теплое время года. Лишь очень небольшая доля органического азота может быть непосредственно использована растениями или животными. Однако суммарная концентрация азота может служить показателем продуктивности, поскольку спустя некоторое время органический азот разрушается с образованием форм, усваиваемых растениями.
В незагрязненных естественных водоемах концентрации неорганических форм азота (аммиак, аммоний, нитриты и нитраты) очень малы; исключение составляет лишь газообразный азот. Эти соединения очень важны для растений, поскольку все они могут усваиваться непосредственно, хотя легче всего усваиваются нитраты. Концентрация газообразного азота определяется главным образом условием равновесия с концентрацией атмосферного азота. На условия формирования равновесия влияет также фиксация азота в воде и анаэробная денитрификация, но об этих процессах известно очень мало.
Как уже отмечалось (см. табл. 6.3), равновесные концентрации аммиака и аммония зависят от значений pH среды. Неионизированный аммиак NH3 весьма токсичен для всех водных организмов. Например, по данным Кнеппа и Аркина (Knepp and Arkin, 1972), для канального сомика LD50 общего аммония составляла 37,9 мг/л. Хотя для этого случая температура воды не была указана, очевидно, ее значения находились в диапазоне между 20 и 30°С. При температуре 20°С и pH 7,8 (см. табл. 6.3) содержание неионизированного аммиака составило 1,13 мг/л. При тех же pH и температуре канальный сомик прекращал питаться при содержании неионизированного аммиака 0,42 мг/л или общего аммония 14 мг/л. По данным Броквея (Brockway, 1950), увеличение содержания неионизированного аммиака свыше 0,3 мг/л резко снижает содержание кислорода в крови форели. Общее содержание аммония (NH3+ NH+4) в природных незагрязненных водах обычно не превышает 1 мг/л, т. е. не достигает токсичных значений. Общее содержание аммония в загрязненных водах может быть высоким и они могут быть токсичными, особенно при pH 7,5—8,0. Основными источниками аммиака в естественных системах можно считать процессы разложения белков бактериями и дезаминирования аминокислот.
Поскольку аммиак является продуктом разложения, естественно предположить, что его концентрация будет неодинакова на различных глубинах озера. Концентрация аммиака в верхних слоях незагрязненных озер обычно невелика. В летний период в эвтрофных озерах концентрация аммиака в гиполимнионе в результате разложения возрастает. Осеннее перемешивание приводит к равномерному распределению аммиака по глубине озера. При этом увеличивается его концентрация в поверхностных слоях и уменьшается концентрация в более глубоких слоях. Аналогично аммиак, образовавшийся в нижних слоях озера в зимний период, распределяется по всей глубине озера при весеннем перемешивании. «Цветение» фитопланктона в фотической зоне в весенний и летний периоды увеличивает потребление биогенных элементов и уменьшает концентрацию аммиака в поверхностных слоях.
Существует два источника поступления нитритов. Первый — нитрификация аммония бактериями типа Nitrosomonas, при которой высвобождаются нитриты NO2-. Энергия, выделяющаяся в этом процессе, используется бактериями при производстве углеводов. Другой источник нитритов NO-2 — восстановление нитратов NO-3. Такой восстановительной способностью обладают некоторые диатомовые и другие водоросли, например Chlorella.
Для незагрязненных озер характерны очень низкие концентрации нитритов. Сезонные изменения концентрации нитритов повторяют колебания концентрации нитратов, за исключением зимнего периода. В конце лета концентрации нитритов, так же как и концентрации нитратов, обычно минимальны. Запас нитратов уменьшается к концу сезона роста, поскольку нитраты необходимы всем зеленым растениям. Низкая концентрация нитратов уменьшает количество восстановленных до нитритов нитратов и соответственно концентрацию нитритов в воде. В начале зимы концентрация аммиака и нитратов уменьшается, а концентрация нитритов возрастает (Reid, 1961). Причина этого необычного явления неизвестна. Вертикальное распределение концентрации нитритов имеет максимум между трофогенной и трофолитической зонами. Максимальная концентрация нитратов обычно обнаруживается у нижней границы трофогенной зоны, тогда как для трофолитической зоны характерно высокое содержание аммиака. Экологическое значение, если оно существует, низких концентраций нитритов пока не выяснено. Высокие концентрации нитритов обычно свидетельствуют о загрязнении водоема сточными водами.
Последним этапом разложения азотсодержащих веществ можно считать окисление нитритов до нитратов, осуществляемое бактериями, например Nitrobacter, которые используют энергию, выделившуюся при окислении нитритов до нитратов, в процессе своей жизнедеятельности. Этот этап имеет большое значение для синтеза белка и других процессов, ^в ходе которых потребляется азот, поскольку азот в форме нитратов легче всего усваивается растениями.
Концентрация нитратов в пресноводных незагрязненных озерах обычно невелика, в среднем около 0,30 мг/л (Reid, 1961). В некоторых очень соленых озерах, например содержащих сульфат магния, в отдельные периоды нитраты могут полностью отсутствовать. В водах оз. Верхнего содержится меньше растворенных веществ, чем в других Великих озерах, обычно около 60 мг/л. Однако, поскольку около 0,86% всех растворенных веществ приходится на долю нитратов, оз. Верхнее имеет самую высокую концентрацию нитратов из всех Великих озер (Reid, 1961). В нормальных условиях в любой данный момент времени содержание нитритов в растворе обусловлено биологическими процессами: дыханием, ростом и фотосинтезом. Содержание нитратов в системе увеличивается в результате бактериальной нитрификации и уменьшается при поглощении их зелеными растениями и при бактериальной денитрификации с образованием свободного азота.
Период максимальной концентрации нитратов в годовом цикле не постоянен для различных озер и зависит от широты, морфологии водоема, химических характеристик водосбора и продуктивности. Вертикальное распределение нитратов в озере в значительной степени зависит от его продуктивности. В верхнем слое эвтрофных озер наблюдается уменьшение содержания нитратов, связанное с поглощением их планктоном. Уменьшение их концентрации в нижних слоях озера обусловлено бакт ериальным восстановлением нитратов. Таким образом, максимальное содержание нитратов наблюдается вблизи нижней границы трофогенной зоны. Хотя в некоторых олиготрофных озерах наблюдается лишь незначительная стратификация по содержанию нитратов, обычно в летний период содержание нитратов в верхних слоях уменьшается по сравнению с периодом весеннего перемешивания. Изменение в течение года концентрации нитратов в более глубоких слоях в этом случае незначительно.
В проточных системах концентрация азота является функцией морфологии бассейна, хозяйственной деятельности, осуществляемой в бассейне, турбулентности, биологических процессов и химического состава пород бассейна. Морфологические и химические характеристики бассейна, а также количество выпадающих осадков определяют объем и химические характеристики стока. Хозяйственная деятельность, осуществляемая в бассейне водосбора, определяется характером ландшафта, что в свою очередь обусловливает азотный состав вод бассейна. Внесение в почву удобрений приводит к загрязнению вод в районах с развитым сельским хозяйством, а вблизи больших городов реки загрязняются бытовыми стоками. Турбулентность потока влияет на обмен вод газообразным азотом с атмосферой.
Фосфор
Фосфор необходим живым организмам для передачи энергии внутри клетки, некоторым ферментным системам, а также для осуществления других внутриклеточных функций. Существуют различные мнения относительно того, какой элемент — фосфор или азот — ограничивает продуктивность водных систем. По-видимому, это зависит от системы, однако один из этих двух биогенных элементов определяет продуктивность большинства пресноводных систем.
В водных системах фосфор встречается в нескольких формах. Наиболее важными формами фосфора являются растворимый неорганический фосфор, растворимый органический фосфор и взвешенный органический фосфор. Фосфор образует химические соединения с ионами многих металлов: кальция, железа, магния, натрия и алюминия. В анаэробных условиях сероводород вступает в реакцию с фосфорнокислым железом с образованием сернистого железа и растворимых соединений фосфора. Эти и аналогичные реакции могут существенно влиять на содержание фосфора в водном столбе. Химические реакции, в которые вступает фосфор, зависят от pH среды. От значений pH зависит также растворимость некоторых продуктов этих реакций. Таким образом, химическая активность фосфора весьма непостоянна. Кинетика многих из этих реакций еще до конца не изучена, поэтому в данной книге эти вопросы подробно не рассматриваются. Интересующихся этим вопросом можно отослать к работе Мартина (Martin, 1970). Здесь же достаточно отметить, что концентрация фосфора в любом пресноводном водоеме зависит от многих факторов: морфометрии бассейна (объем, стратификация и перемещение водных масс); химического состава водосбора; характеристики бассейна реки с точки зрения возможности внесения органических веществ в водоем; биологических процессов, протекающих в водоеме; времени круговорота фосфора в воде; pH системы; времени перехода фосфора в осадочные отложения; концентрации ионов кальция, магния и железа; содержания кислорода в воде; температуры воды и времени года.
Сезонные колебания содержания фосфора в озерах весьма значительны, поскольку они в значительной степени определяются формой бассейна, химическим составом водосбора, характером хозяйственной деятельности в районе водосбора, составом других растворенных веществ в воде озера, характером перемешивания в озере, происхождением питающих озеро источников и протекающими в озере биологическими процессами. Содержание фосфора в озерах, имеющих большой приток, может определяться этим притоком, особенно в периоды большого сброса воды. Например, р. Мауми вносит ежегодно 96 т растворимого фосфата в оз. Эри, однако 68% этого количества поступает в озеро в течение января и февраля, когда сброс реки максимален (Reid, 1961). В других озерах с более независимой динамикой вод сезонные колебания общего содержания фосфора и его вертикальное распределение связаны довольно сложным образом с реакциями фосфора с другими присутствующими в системе соединениями и характером перемешивания в озере. В эвтрофных озерах в период летней стратификации содержание фосфора в гиполимнионе при уменьшении содержания кислорода резко возрастает. Причины этого явления до конца не выяснены, однако есть данные, подтверждающие существование зависимости между образованием комплексных соединений железа и фосфора и содержанием кислорода. Обеднение кислородом ведет к восстановлению ионов железа и высвобождению фосфора. В верхних слоях эвтрофных озер низкое содержание фосфора наблюдается в течение всего года. В летний период поверхностные слои могут оказаться полностью обедненными фосфором. В конце лета концентрация фосфора (в основном органического) увеличивается.
Утилизация фосфора бактериями имеет огромное экологическое значение, поскольку они поглощают большие, количества фосфора и либо ассимилируют его, либо трансформируют в органическую форму, которая не поглощается зелеными растениями. В отсутствие бактерий водоросли и укорененные растения интенсивно поглощают фосфор. Очевидно, что между бактериями, водорослями и прочими растениями существует конкуренция за фосфор, причем значительная его доля достается бактериям, обладающим повышенной скоростью поглощения. По закону минимума это лимитирует продуктивность водорослей и высших растений, а следовательно, и всей водной системы. В настоящее время нет данных о количествах фосфора, необходимых для роста растений. Полученные в лабораторных исследованиях значения минимально необходимых концентраций часто превышают концентрации, обнаруженные в естественных водоемах, в которых произрастают водоросли. Вместе с тем лабораторные исследования позволяют предположить, что слишком высокие концентрации фосфора ингибируют рост планктона.
Железо
В водных системах железо встречается как в двухвалентной, так и в трехвалентной форме. Соединения двухвалентного железа растворимы только в анаэробных условиях. В присутствии кислорода трехвалентное железо существует в виде коллоидного комплекса с другими неорганическими ионами и простыми продуктами разложения. Недостаток кислорода вызывает переход трехвалентных форм в двухвалентные. Этот переход часто приводит к увеличению концентрации силикатов, фосфатов, бикарбонатов и железа в зависимости от химического состава воды. Следует отметить, что само по себе отсутствие кислорода не вызывает перехода трехвалентных форм в двухвалентные. Разложение органических веществ приводит к обеднению среды кислородом и образованию органических соединений, уменьшающих валентность железа. Однако в некоторых случаях, например для уменьшения валентности трехвалентного бикарбоната железа, требуется не только низкая концентрация кислорода и присутствие органических соединений, но и наличие нейтральной или кислой среды и высокой концентрации двуокиси углерода.
Вертикальное распределение перечисленных выше соединений железа представляет собой сложную картину. Химические условия эпилимниона большинства озер определяют низкие (обычно менее 0,2 мг/л) концентрации железа в этом слое. Концентрации железа в более глубоких слоях зависят от содержания кислорода и окислительно-восстановительного потенциала. В гиполимнионе олиготрофных озер, где дефицит кислорода наблюдается редко, железо в основном встречается в виде нерастворимых трехвалентных соединений. Для эвтрофных озер в период летней стратификации дефицит кислорода — обычное явление. В этих условиях образуются растворимые соединения двухвалентного железа и концентрация железа в воде снижается.1
Окисление двухвалентного железа в воде, содержащей растворенные соли двухвалентного железа, приводит к образованию гидроокиси железа Fe(OH)3 — формы, в которой железо легче всего усваивается фитопланктоном.2 Чаще всего она представляет собой бесформенную массу, состоящую из железа и органических соединений. Некоторые типы бактерий утилизируют органические компоненты этой массы, что приводит к осаждению побочного продукта — трехвалентной гидроокиси железа; в результате этого образуется озерная охра, из которой затем получается железная руда.
Сера. Вторым, наиболее часто встречающимся в водах североамериканских озер элементом является сера, на долю которой приходится около 15% всех растворенных твердых веществ. Несмотря на довольно высокое содержание серы оно вдвое меньше содержания карбонатов. В пресноводных системах сера чаще всего встречается в виде сульфатов SO2-4 в сочетании с различными катионами и в виде сероводорода H2S. Хотя сера не обладает высокой растворимостью, она попадает в водоемы в основном с дождями или в результате растворения серусодержащих геологических образований. В табл. 6.4 приведены средние концентрации некоторых ионов для различных пресноводных водоемов.
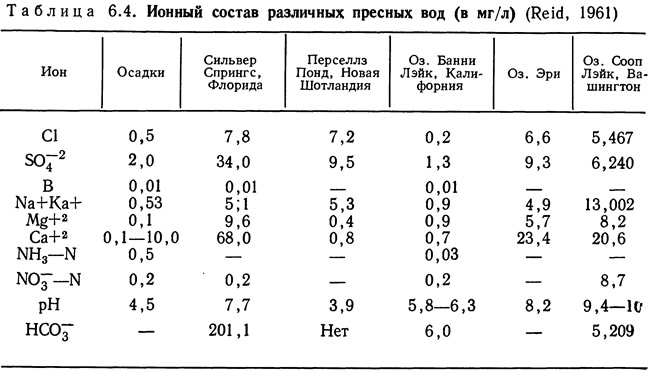
Для некоторых озер характерны сезонные изменения концентраций сульфатов, противоположные по характеру изменениям концентраций бикарбонатов. В некоторых из таких озер концентрации сульфатов максимальны весной; в летний период концентрации постепенно уменьшаются и осенью достигают минимальных значений. Причины этого окончательно не выяснены, однако было высказано предположение, что уменьшение содержания сульфатов вызвано восстановлением до сульфидов, поглощаемых донным илом. Очевидно, что концентрация бикарбонатов частично зависит от поглощения двуокиси углерода в процессе фотосинтеза, а частично от участия серной кислоты в растворении карбонатов при окислении сульфидов в зимний период (Reid, 1961).
Утилизация серных соединений осуществляется несколькими типами серных бактерий:
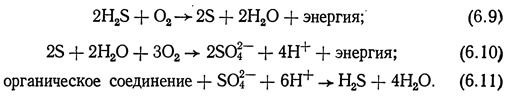
Эти уравнения показывают, что бактерии используют окисление сероводорода и серы как источник энергии для осуществления своей жизнедеятельности. Для производства сероводорода из сульфидов также требуется энергия, выделяющаяся при окислении органических веществ.
Кальций и магний
Суммарное содержание ионов кальция и магния превышает содержание ионов любого другого вещества в пресноводных водоемах. Их концентрация в любой пресноводной системе зависит от химических характеристик водосбора, а также от химических и биологических процессов, происходящих в самой системе. Воды, собранные с территорий с высоким содержанием кальция и магния в породе и почве (например, области со значительным количеством осадочных пород), являются жесткими, т. е. содержат большие количества кальция и магния. Поскольку карбонаты кальция и магния в природе встречаются часто, процессы фотосинтеза, дыхания и разложения влияют на концентрацию этих элементов посредством буферной системы двуокиси углерода. Значительные количества содержащегося в воде кальция расходуются на образование панцирей и костей живых водных организмов. Кальций и в меньшей степени магний образуют соединения с различными фосфорсодержащими веществами. Концентрация кислорода, влияющая на химию фосфора, обусловливает также химию кальция и магния. Хотя существуют многочисленные описания реакций, протекающих в водных системах, они не дают адекватного представления о комплексной картине происходящих изменений.
Концентрации карбоната кальция в реках, так же как и в озерах, зависят от типа и количества водорослей. При благоприятных условиях кальций может осаждаться в виде монокарбоната в результате деятельности растений. Содержание магния в реках колеблется от 500 мг/л до следовых значений. Отношение содержания кальция к содержанию магния для пресноводных систем может составлять от 2:1 до 10:1 и более (Reid, 1961).
Выделение двуокиси углерода из воды в атмосферу или ее потребление в процессе фотосинтеза приводит к осаждению карбоната кальция. Многие виды водорослей и некоторые высшие растения способны осаждать известь (СаСО3) при поглощении двуокиси углерода в процессе фотосинтеза. Некоторые растения могут потреблять двуокись углерода непосредственно из бикарбоната при отсутствии свободной двуокиси углерода. Было показано, что дефицит фосфатов приводит к уменьшению содержания двуокиси углерода в воде, что ускоряет осаждение карбоната кальция.
Кремний
Породы и почвы земной коры более чем на 60% состоят из двуокиси кремния (SiO2), поэтому, хотя кремний почти не растворяется в воде, в низких концентрациях он присутствует в водах всех природных водоемов. По химическим свойствам кремний близок к углероду, однако он нерастворим в воде и не способен образовывать газ при обычных атмосферных условиях.
Кремний не входит в число основных компонентов протоплазмы растений и животных, хотя и относится к необходимым элементам. Он необходим для образования оболочки или скелетов некоторых диатомовых водорослей, цист желтокоричневых водорослей и скелетных спикул некоторых кремниевых губок. Для развития таких диатомовых водорослей, как Asterionella, Melosira и Tabellaria, кремний необходим в концентрации от 0,5 до 0,8 мг/л.
Натрий и калий
По своему лимнологическому значению и геохимическим характеристикам натрий и калий сходны. В водах с низкими концентрациями натрия и калия обычно наблюдается несколько повышенная концентрация натрия. При увеличении концентрации обоих элементов концентрация натрия обычно возрастает значительно быстрее. В мягкой озерной воде концентрации натрия высоки и уступают только концентрации кальция; в жесткой озерной воде как концентрация кальция, так и концентрация магния превышают концентрации натрия (Reid, 1961).
В водоемах натрий присутствует в виде ионов Na+, тетрабората натрия Na2B4O7 или сульфата натрия Na2SO4, однако чаще всего встречается ионная форма. Калий также чаще всего встречается в естественных водоемах в ионной форме К+.
Прочие элементы
Рассмотренные выше элементы присутствуют в наибольших количествах в пресноводных системах и являются наиболее важными с биологической точки зрения, поскольку они обычно определяют первичную продуктивность этих систем. Однако в пресноводных системах содержится также много растворенных или взвешенных микроэлементов. В необычных условиях одно из этих питательных веществ может лимитировать продуктивность системы. Существует теория, согласно которой в водных системах присутствуют все существующие в природе элементы. Однако в настоящее время эта теория не может быть проверена, поскольку некоторые элементы присутствуют в водных системах в таких малых количествах, что не могут быть зарегистрированы даже самыми совершенными из существующих приборов.
Существует, однако, группа элементов, присутствующих во многих водоемах в достаточных для обнаружения концентрациях. К этой группе относятся марганец, алюминий, цинк, медь, хром, титан, молибден, йод, свинец, барий, бром и стронций, довольно часто встречающиеся в поверхностных водах. В поверхностных водах были также обнаружены многие другие элементы: от тяжелых металлов, таких, как уран и вольфрам, и драгоценных металлов — серебра и золота — до менее экзотических цезия и галлия. Турекян (Turekian, 1969) определил концентрации в естественных водоемах элементов с атомными номерами от 21 до 92. В его работе приведены концентрации, по крайней мере, 43 элементов из 72.
Органические вещества
Во всех естественных водоемах содержатся органические вещества, хотя их концентрация в разных озерах значительно различается. Органические вещества могут быть взвешены или растворены в водоемах. Они могут поступать в пресноводную систему с втекающей в нее водой, в результате волнового и эолового разрушения берегов, а также создаваться в самом водоеме обитающими там живыми организмами. Впадающие в озера реки выносят органическое вещество из своих бассейнов, подземные воды вымывают органические вещества из почвы. Свой вклад в содержание органических веществ вносят и органические загрязнения. В результате протекающих в водоемах биологических процессов, в первую очередь разложения мертвых растений и животных, там образуется органическое вещество. Некоторые организмы выделяют непосредственно в воду органические вещества, образовавшиеся в процессе их жизнедеятельности. В настоящее время относительный вклад органического вещества в результате каждого из описанных выше процессов четко не определен, однако можно сказать, что он значительно различается для разных водоемов и колеблется в зависимости от сезона для каждого конкретного водоема.
Озера значительно различаются как по суммарной концентрации органических веществ, так и по соотношению содержания взвешенного и растворенного органического вещества. Содержание углерода в бедных органическими веществами озерах колеблется от 1 до 2 мг/л, причем углеводы составляют более 73% общего количества, а белки — около 24%. В богатых органическими веществами озерах содержание углерода может достигать 26 мг/л, при этом на долю углеводов приходится 90% и белков — 10%. В бедных органическим веществом озерах около 16 % органических веществ связано с наличием сестона, в то время как в богатых органическим веществом озерах — только около 4% (Reid, 1961). Содержание взвешенных веществ в озерах возрастает с увеличением концентрации растворенных органических веществ до достижения некоторой предельной величины; при дальнейшем увеличении концентрации растворенного органического вещества содержание сестона, по-видимому, не изменяется. Было также показано, что содержание белков в органических веществах, вносимых в озеро извне, мало (Reid, 1961).
Часто цвет озера зависит от происхождения содержащихся в нем органических веществ. Органическое вещество,, поступающее из торфяных болот или мелководных водоемов с остатками растений, имеет темно-коричневый цвет и характеризуется высоким содержанием углеводов по сравнению с содержанием белков в общем объеме органического вещества. Бесцветные воды содержат в основном органическое вещество, образованное в самом водоеме. Это органическое вещество образуется при разложении планктона и характеризуется относительно высоким содержанием белков. Цвет и происхождение органического вещества, по-видимому, связаны также с продуктивностью планктона. На долю планктона может приходиться не более 3% общего количества органического вещества в сильно окрашенных водах с высоким содержанием органического вещества, поступившего из внешних источников. В прозрачных водах с низким содержанием органических веществ из-внешних источников планктонные остатки могут составлять более 25% органического вещества (Reid, 1961).
В морской воде, как правило, содержится около 2 мг углерода и 0,2 мг органического азота на 1 л; в озерной воде содержание этих веществ обычно в 3—4 раза выше (Reid, 1961). По-видимому, это обстоятельство влияет на содержание органического вещества в эстуариях, но гораздо большее значение для эстуариев имеют сброс речной воды, характер водосбора, а также размер и тип маршей вокруг эстуария.
Соединения, из которых состоят органические вещества, обнаруженные в пресных и морских водах, исключительно разнообразны. Экологическое значение многих из этих соединений не выяснено. В настоящее время известно, что некоторые бактерии потребляют органические вещества с выделением энергии и образованием побочных продуктов. К соединениям, обнаруженным в пресных и морских водах и донных отложениях, относятся простые по-структуре молекулы жирных кислот, свободные аминокислоты, триптофан, глицин, глутаминовая кислота, тирозин, сахара и также такие сахароподобные соединения, как глюкоза, галактоза и многие другие. Из осадочных отложений были также выделены кислоты и парафины. В пресных и морских водах содержатся витамины А и С. Известно, что в озерной воде содержится до 0,9 мг/м3 ниацина (витамин В6), а также тиамин (витамин B1) и биотин (витамин Н). В водах всех природных водоемов обнаружены ферменты, которые, по-видимому, участвуют в некоторых биологических Процессах, протекающих в окружающей среде. В пресных водоемах и на морском мелководье было обнаружено желтое каротиноидное вещество, обладающее флуоресцентными свойствами (Reid, 1961).
Некоторые водные организмы, в частности водоросли, выделяют вещества, способные замедлять, стимулировать или регулировать развитие естественных популяций других водорослей. Природа этих веществ в настоящее время точно не известна; тем более непонятен механизм их действия. Существует предположение, что это гормоноподобные вещества или жирные кислоты, а возможно, комбинация тех и других.
Примечания
1. На самом деле концентрация железа в это время увеличивается.
2. Легче усваивается двухвалентное железо.
