Буферная система
Круговорот углерода в природе имеет огромное значение, поскольку все живое на Земле содержит органические соединения. Перенос углерода осуществляется в основном в форме двуокиси углерода. Двуокись углерода обладает термодинамической стабильностью в широком диапазоне условий окружающей среды, в частности устойчивостью к окислению, участвует в фотосинтезе, хорошо растворяется в морской воде или переносится океанскими течениями, быстро диффундирует в атмосферу. Из всех соединений углерода только СО2 обладает такими физическими и химическими свойствами. Все это делает двуокись углерода идеальным переносчиком углерода (табл. 5.1). Больше всего двуокиси углерода содержится в карбонатных породах, на втором месте по запасам углерода стоит органический углерод в породах, на третьем — воды океана.

Трудно переоценить значение двуокиси углерода для живых организмов. Двуокись углерода и вода поставляют в протоплазму три важнейших элемента: водород, кислород и углерод. Двуокись углерода играет тройную роль в превращении воды в пригодную для жизни среду. Во-первых, взаимодействуя с водой, она формирует естественную буферную систему, обеспечивающую относительное постоянство pH в водной среде. Во-вторых, двуокись углерода необходима для таких биологических процессов, как фотосинтез, дыхание и прорастание некоторых семян. В-третьих, она является носителем углерода. Этот элемент образует огромное количество соединений. Углерод может формировать длинные молекулярные цепи главным образом благодаря тому, что на его внешней орбите вращаются четыре электрона.
Двуокись углерода поступает в природные воды из многих источников. Она продуцируется при разложении органического вещества, выделяется животными и растениями при дыхании. В подземные воды двуокись углерода попадает при просачивании сквозь почву, где также происходит разложение органических веществ, и выносится в озера, ручьи или океаны. Двуокись углерода образуется в водной среде при взаимодействии кислот с различными карбонатными соединениями.
Атмосфера, в которой содержится 0,03% двуокиси углерода, является еще одним ее источником для природных вод. При этом двуокись углерода может непосредственно диффундировать через поверхность раздела вода — воздух или приноситься с осадками, проходящими сквозь толщу атмосферы.
В природных водных системах двуокись углерода редко встречается в виде газа. При растворении двуокиси углерода (СО2) в воде часть ее участвует в образовании угольной кислоты (Н2СО3). Эта слабая кислота взаимодействует с такими карбонатсодержащими породами, как известняк (СаСО3), с образованием бикарбоната кальция Са(СО3)2. Бикарбонат диссоциирует с образованием водородных и карбонатных ионов, поэтому растворение двуокиси углерода в воде описывается не простым химическим уравнением, а серией уравнений, находящихся в динамическом равновесии:
Таким образом, двуокись углерода находится в воде в четырех формах: свободный газ (СО2), угольная кислота (Н2СО3), бикарбонатный (НСО-3) и карбонатный (СО2-3) радикалы. Первые две формы СО2 и Н2СО3 вместе называются свободной, или равновесной, двуокисью углерода, а последние две НСО-3 и СО2-3 — связанной двуокисью углерода. Двуокись углерода в форме НСО-3 иногда называют полусвязанной.
Химические реакции, описываемые уравнением (5.1), очень чувствительны к концентрации водородных ионов. Поскольку pH по определению является показателем концентрации водородных ионов, реакция, описываемая уравнением (5.1), в большей степени зависит от pH раствора. Математически pH выражается следующим образом:
где [Н+] — концентрация ионов водорода.
С увеличением pH равновесие в реакциях,, описываемых уравнением (5.1), сдвигается вправо, а с уменьшением — влево. Однако химическая система в уравнении (5.1) представляет собой буферную систему, сопротивляющуюся любым изменениям pH. Если в эту так называемую карбонатную систему добавить кислоту, концентрация ионов водорода увеличится. При этом частная реакция 1 [уравнение (5.3)] остается относительно стабильной, поскольку в обеих частях содержатся ионы Н+:
В частной реакции 2 равновесие сдвигается влево, компенсируя изменение концентрации Н+-ионов:
Поскольку концентрация угольной кислоты (Н2СO3) увеличилась, в частной реакции 3 равновесие также смещается, что приводит к увеличению количества двуокиси углерода и воды:
Смещение равновесия в уравнении (5.4) уменьшает количество НСО-3. Однако содержание бикарбоната (НСО-3) может быть восполнено из карбонатных отложений по реакциям, описываемым следующими уравнениями:

В результате этих реакций [уравнения (5.3) — (5.6)] большая часть ионов Н+, добавленных в виде кислоты, оказывается связанной в Н2O, Н2СO3 и НСО-3. Связанный водород, входящий в эти три соединения, не изменяет pH. Таким образом, буферная карбонатная система обеспечивает определенное постоянство величины pH. Как видно из приведенного ниже уравнения, реакции, аналогичные описанным выше, происходят при добавлении в систему оснований:
В ходе биологических процессов двуокись углерода выделяется в раствор или поглощается из него. Если в буферную систему [уравнение (5.1)] добавляется двуокись углерода, система буфери-рует, поддерживая постоянную величину pH. Поглощение двуокиси углерода зелеными растениями требует новой перестройки системы, но она поддерживает pH на прежнем уровне.
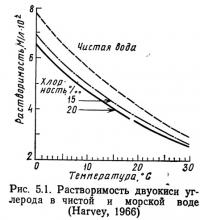
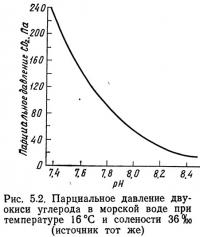
На рис. 5.1 показана растворимость двуокиси углерода в воде. На рис. 5.2 представлено парциальное давление двуокиси углерода в морской воде в некотором диапазоне значений pH. Как видно из рисунков, растворимость двуокиси углерода уменьшается с увеличением температуры и солености. Кроме того, при температурах, характерных для природных вод, двуокись углерода значительно лучше растворяется в воде, чем кислород. Например, при температуре 20°С и давлении 760 мм рт. ст. пресная вода, находящаяся в равновесии с атмосферой, содержит около 7,9 мг двуокиси углерода в 1 л и только около 8,6 мг кислорода в 1 л. В воздухе концентрация кислорода почти в 700 раз превышает концентрацию двуокиси углерода, в то время как в воде, находящейся в равновесии с атмосферой, только в 1,09 раза.
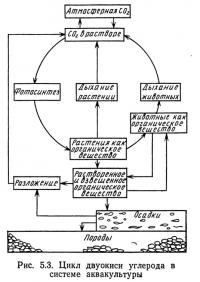
На рис. 5.3 представлен биологический цикл двуокиси углерода в водной системе. Растения потребляют двуокись углерода при фотосинтезе и выделяют при дыхании. Поглощаемая растениями двуокись углерода высвобождается при дыхании растений и животных, бактериальном и химическом разложении. Высвобождаемая в результате этих процессов двуокись углерода при фотосинтезе снова включается в круговорот углерода. Водные растения используют извлеченную из воды двуокись углерода как источник углерода.
Пресноводные системы
Содержание двуокиси углерода в водоемах и водотоках в значительной степени зависит от вида почвы и пород водосборного бассейна. В районах с преобладанием изверженных пород общее количество двуокиси углерода обычно довольно мало из-за недостатка карбонатного субстрата. Содержание биогенных элементов в водоемах и водотоках этих районов также невелико в связи со слабой растворимостью изверженных пород. Недостаток питательных солей лимитирует биологическую активность и, следовательно, продуцирование двуокиси углерода в процессах дыхания и разложения. Воды озер, рек и ручьев в районах с изверженными породами слегка подкислены (pH около 6) и обладают некоторой коррозионной способностью (Russell-Hunter, 1970).
Пресноводные системы, которые расположены в районах, сложенных преимущественно из известняков, богаты двуокисью углерода. Большинство осадочных пород (например, известняк) мягче изверженных и поэтому разрушаются значительно быстрее. Эти породы и образующиеся на них почвы богаты карбонатами и бикарбонатами, поэтому протекающие по ним воды имеют высокие pH (7,0 и выше), содержат много связанной двуокиси углерода и мало свободной С02. Поскольку двуокись углерода обычно связана в карбонаты кальция и магния в породах, эти воды богаты кальцием и магнием и относятся к жестким водам.
Как уже отмечалось в главе 2, воды часто классифицируются по «жесткости». Хотя жесткость является показателем количества ионов кальция и магния, она также тесно связана с содержанием в воде двуокиси углерода. Поверхностные воды, протекающие через обширные болота, топи, обычно несколько подкислены, что связано с высокими скоростями разложения. Свободная двуокись углерода, продуцируемая в процессах разложения органических веществ, понижает pH этих вод обычно до 4—6. Концентрация свободной двуокиси углерода очень высока (до 200 мг/л), а связанной двуокиси углерода — низка (10 мг/л и менее) (Reid, 1961). Воды с такими характеристиками обычно называют «мягкими». Воды с умеренной жесткостью имеют pH от 7 до 9. Содержание свободной двуокиси углерода в этих водах широко варьирует и может даже превышать уровень равновесного насыщения. Концентрация связанной двуокиси углерода обычно находится в пределах 30—35 мг/л. Высокая жесткость вод характерна для озер и водотоков в районах, сложенных осадочными породами, которые сравнительно легко растворяются. Переходящие при этом в раствор карбонаты подлепживают величину pH выше 8,5. Типичная для этих вод концентрация связанной двуокиси углерода составляет 35—40 мг/л и выше. В некоторых очень соленых озерах концентрация карбонатов может достигать 8500 мг/л (Reid, 1961). В озерах с жесткой водой карбонаты кальция и магния могут выпадать в осадок в виде мергеля.
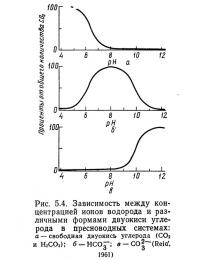
Зависимость pH от концентрации различных форм двуокиси углерода в пресных водах может быть изображена графически (рис. 5.4). Низкие значения pH «благоприятны» для присутствия свободной двуокиси углерода. При увеличении pH до 8 равновесие сдвигается в сторону образования бикарбоната (НСО-3), что приводит к уменьшению количества свободной двуокиси углерода. При pH около 8 почти 100 % двуокиси углерода представлено бикарбонатом. Дальнейшее увеличение pH (более 8) приводит к пропорциональному уменьшению бцкарбонатной (НСО-3) формы и увеличению карбонатной (СO2-3). При pH более 12 вся двуокись углерода представлена карбонатами. Природные воды могут иметь pH от 2 до 12, но в большинстве пресноводных систем pH составляет 6—9. В этом диапазоне основной формой двуокиси углерода является бикарбонат.
Сезонные колебания концентрации двуокиси углерода в димикти-ческом озере находятся в противо-фазе с колебаниями концентрации кислорода. Зимой озеро изолировано от атмосферы льдом, образуется градиент концентрации газа от поверхности к дну. Около поверхности, особенно если проникающего сквозь лед света достаточно для фотосинтеза, двуокиси углерода очень мало, а свободная двуокись углерода отсутствует либо присутствует в незначительном количестве. Вода здесь имеет слабую щелочную реакцию, концентрация бикарбонатов в ней низка, а карбонаты отсутствуют. Необходимо помнить, что карбонаты присутствуют только тогда, когда в воде нет свободной двуокиси углерода. В глубинных водах разложение приводит к увеличению концентрации бикарбонатов и свободной двуокиси углерода, но при этом pH и концентрация кислорода снижаются.
В теплых районах умеренной климатической зоны зимой в озерах происходит вертикальная циркуляция, поэтому концентрация двуокиси углерода в них практически одинакова по всей глубине.
Весеннее перемешивание вод охватывает всю глубину голомиктического озера и приводит к выравниванию pH во всей толще вод. Излишки свободной двуокиси углерода, накопленной в зимнее время при разложении органических веществ, высвобождаются в атмосферу. С потерей излишков свободной двуокиси углерода и с увеличением ее потребления при фотосинтезе в поверхностном слое озер с умеренными и жесткими водами связанная двуокись углерода проявляется в виде карбонатов. Это происходит одновременно с развитием летней плотностной стратификации.
В продуктивных голомиктических озерах в летнее время наблюдается обратная зависимость между концентрацией двуокиси углерода и кислорода. В то время как содержание кислорода с глубиной уменьшается, содержание двуокиси углерода несколько увеличивается. В летнее время в эпилимнионе озер с умеренной и жесткой водой обычно отсутствует свободная двуокись углерода, но присутствует некоторое количество карбонатов.
Во время осеннего перемешивания избыток газа, накопленный за лето при разложении органических веществ в гиполимнионе, высвобождается в атмосферу, и по всей глубине устанавливается одинаковая концентрация. Осеннее понижение температуры способствует поглощению большего количества кислорода. Проточные водные системы, за исключением огромных рек с медленным течением, не имеют выраженного годового цикла двуокиси углерода. Перемешивание предотвращает развитие стратификации и образование градиентов концентрации двуокиси углерода. Основным фактором, определяющим pH и формы углерода в водах рек и ручьев, является химический состав пород, слагающих водосборный бассейн. Биологические процессы (фотосинтез, дыхание, разложение) также оказывают определенное влияние на баланс двуокиси углерода в системе.
Морские системы
Концентрация двуокиси углерода уменьшается с увеличением как солености, так и температуры воды. Воды поверхностного слоя океана в полярных районах холоднее, чем в районе экватора, поэтому более холодные полярные воды поглощают двуокись углерода из атмосферы и переносят ее к тропикам. Теплые соленые поверхностные воды тропических районов не могут содержать большого количества двуокиси углерода, поэтому часть ее выделяется в атмосферу. Таким образом, океан работает как насос, «перекачивая» двуокись углерода из полярных районов в тропические.
Описанная выше буферная система существует как в пресных, так и в соленых водах. Однако в соленых водах избыток оснований, или щелочного резерва, делает буферную систему еще более эффективной. В основном pH в поверхностных водах океанов составляет 8,1—8,3 (Raymont, 1963). Однако для океанов в целом диапазон изменений pH шире: от 7,5 до 8,4. Фотосинтез способствует увеличению pH, а дыхание и разложение — уменьшению. Ниже фотической зоны значения pH убывают под влиянием двух последних процессов. В зоне кислородного минимума pH может составлять около 7,7. Ниже этой зоны он постепенно увеличивается и в хорошо аэрируемых (богатых кислородом) глубинных водах достигает примерно 8. В наиболее глубоководных районах океана огромное давление приводит к понижению pH до 7,9. Весьма низкие значения pH наблюдаются в зоне кислородного минимума Тихого океана — около 7,5 (Raymont, 1963).
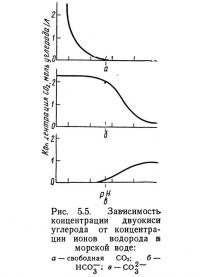
Соотношение различных форм двуокиси углерода в океанских водах показано на рис. 5.5. Очевидно, что с увеличением pH общее содержание двуокиси углерода в морской воде уменьшается. Когда величина pH достигает 8, концентрация свободной двуокиси углерода снижается до 0. При pH менее 8 ионы СО2-3 в воде практически отсутствуют, с увеличением pH концентрация их увеличивается. Концентрация ионов бикарбоната остается высокой и постоянной при увеличении pH до 7,5—8, при дальнейшем росте pH она уменьшается. Буферная система и особенно присутствующие в океане основания увеличивают способность морской воды поглощать двуокись углерода. Если бы, допустим, морская вода была нейтральна (pH 7), т. е. не имела избытка оснований, то при стандартной температуре и давлении (СТД) в 1 л могло бы раствориться только примерно 0,5 см3 двуокиси углерода. При имеющемся избытке оснований в 1 л морской воды можно будет растворить около 45 см3 двуокиси углерода.
Поскольку между pH и общим содержанием двуокиси углерода в морской воде существует непосредственная зависимость, можно подсчитать количество фотосинтетической продукции, обусловленное изменением pH. Например, если в процессе фотосинтеза pH увеличился с 8,16 до 8,31 при температуре 15°С, из каждого литра воды должно выделиться 2,24 см3 двуокиси углерода. Поскольку 1 моль двуокиси углерода при стандартной температуре и давлении занимает объем 22,4 л, 2,24 см3 соответствуют 0,0001 моль. В одном моле двуокиси углерода содержится 12 г углерода, следовательно в 0,0001 моль — 0,0012 г. Если предположить, что весь углерод, входящий в двуокись углерода, превращен в органическое вещество растительных клеток» то можно считать, что увеличение pH на 0,15 эквивалентно синтезу 1,2 мг углерода (Raymont, 1963).
Солоноватоводные системы
Концентрация двуокиси углерода в солоноватоводных системах определяется температурой, соленостью и химическим составом подстилающих пород. Основными биологическими факторами, от которых зависит содержание двуокиси углерода, являются фотосинтез, дыхание и разложение. В верховьях эстуариев преобладают пресные воды. Концентрация двуокиси углерода обусловлена в основном биологическими процессами и температурой. Поскольку температура воды в реке подвержена большим колебаниям, чем в океане, концентрация двуокиси углерода в верхней части эстуария также в значительной степени варьирует. По мере продвижения вод вниз по течению эстуария соленость их увеличивается, что приводит к уменьшению концентраций равновесного насыщения двуокиси углерода. В морской воде содержится избыток оснований, что вызывает уменьшение концентрации свободной двуокиси углерода и увеличение концентрации карбонатов и бикарбонатов.. При смешении пресных вод с морскими часто происходят значительные химические изменения, связанные с коагуляцией и осаждением взвешенных частиц, особенно если пресные воды имеют слабую кислую реакцию. Вниз по течению эстуария pH возрастает до 8,1—8,3.
Диапазон изменений pH и концентрации двуокиси углерода в пресноводной (верхней по течению) области эстуария шире, чем в солоноводной (нижней по течению). Кроме того, воды верхней части эстуария менее забуферены, чем воды нижней по течению части, так как последние находятся под влиянием соленых вод с избытком оснований.
Для каждого эстуария характерны определенные закономерности распределения двуокиси углерода, обусловленные колебаниями температуры, солености, притоком пресных вод, приливными явлениями и биологическими процессами, поэтому трудно выявить общие закономерности для всех эстуариев. Однако при отсутствии конкретных данных для эстуария в первом приближении можно считать, что распределение двуокиси углерода обратно распределению кислорода, а распределение pH — обратно распределению свободной двуокиси углерода, в то же время между pH и концентрацией кислорода существует прямая зависимость. (Последнее утверждение также носит предположительный характер и может быть использовано только при отсутствии конкретных данных).
Роль двуокиси углерода в жизнедеятельности водных организмов
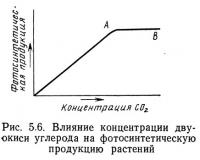
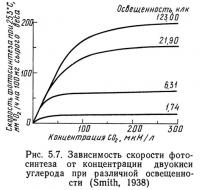
Двуокись углерода обеспечивает фотосинтезирующие расте-<ния углеродом, который необходим для продуцирования органического вещества, поэтому содержание ее в воде непосредственно влияет на фотосинтетическую продукцию (рис. 5.6). Ниже точки А на рис. 5.6 продукция линейно связана с концентрацией двуокиси углерода. При дальнейшем увеличении концентрации (отрезок АВ) фотосинтетическая продукция не увеличивается, т. е. уже не зависит от концентрации двуокиси углерода. Изменение наклона кривой в точке А свидетельствует о том, что уже не двуокись углерода, а другой фактор лимитирует дальнейшее увеличение продукции. Это явление известно под названием закона минимума, установленного Либихом. Этот закон можно сформулировать следующим образом: продукция увеличивается до тех пор, пока не исчерпаны ресурсы наиболее лимитирующего фактора, необходимого для роста. На рис. 5.6 до точки А лимитирующим фактором, является двуокись углерода, поэтому увеличение фотосинтетичес-кой продукции пропорционально увеличению ее концентрации. Выше точки А двуокись углерода перестает быть лимитирующим фактором, и дальнейшее увеличение ее концентрации не отражается на продукции фотосинтеза. На рис. 5.7 показано влияние изменения концентрации двуокиси углерода и освещенности на скорость фотосинтеза. При низкой освещенности продукция лимитируется светом, несмотря на увеличение концентрации двуокиси углерода, кривая на графике очень полога и почти на всем протяжении параллельна оси абсцисс. При повышенном уровне освещенности количество двуокиси углерода, которое может быть эффективно утилизировано растениями, увеличивается, хотя свет по-прежнему остается лимитирующим фактором, что на рис. 5.7 выражается уменьшением наклона кривой.
Выше уже отмечалось, что содержание двуокиси углерода в атмосфере может лимитировать продукцию зерновых в некоторых высокопродуктивных районах. В водной среде концентрация двуокиси углерода значительно выше. При значениях pH, которые наблюдаются в океанах (8,1—8,3), в воде содержится мало свободной двуокиси углерода, которая наиболее легко усваивается растениями, однако концентрация бикарбонатов и карбонатов высока. Некоторые растения утилизируют непосредственно бикарбонаты, если свободная двуокись углерода отсутствует. То же самое происходит в пресноводных системах при pH более 8, при pH менее 8 свободная углекислота присутствует в водной среде.
Процессы дыхания и разложения органического вещества являются биологическим источником двуокиси углерода в водных системах. Поскольку при этом потребляется кислород, о пригодности системы для водных организмов обычно судят по концентрации кислорода, а не двуокиси углерода, концентрация которой высока. Возможна такая ситуация, когда содержание и кислорода, и двуокиси углерода в воде очень велико, однако вероятность такого совпадения столь мала, что при использовании для определения качества воды системы контроля кислорода можно не принимать ее во внимание. Двуокись углерода, которая преимущественно поглощается кровью, при высоких концентрациях может осложнить условия обитания водных организмов независимо от содержания в воде кислорода.
Содержание двуокиси углерода в системах культивирования гидробионтов можно контролировать, регулируя pH и поддерживая концентрацию кислорода на определенном уровне с помощью аэрирования. Высокая концентрация бактериального и взвешенного органического вещества способствует развитию дефицита кислорода и накоплению двуокиси углерода. В системы для культивирования водорослей двуокись углерода добавляют с целью уменьшения скорости роста.
Азот
Значение азота для водных организмов велико, так как он является составной частью белков. Однако лишь немногие организмы могут усваивать свободный азот, поглощаемый из атмосферы (N2 или несвязанный азот). Использование молекулярного азота для построения белка требует затрат энергии. Организмы, способные усваивать свободный азот, называются азотфиксирующими. Азот в воде присутствует и в других химических формах (более подробно см. главу 6).
Азот — наиболее распространенный инертный газ пресноводных и морских систем. Поглощение водой атмосферного азота зависит от температуры и солености воды, степени возмущенности поверхности раздела вода — воздух, парциального давления азота в воде, т. е. от тех же факторов, от которых зависит поглощение водой кислорода. В атмосфере содержится 78% азота, поэтому не удивительно, что в природных водах концентрация азота выше, чем кислорода. С увеличением солености и температуры концентрация равновесного насыщения азота в воде уменьшается.
С азотом обычно связано развитие газовой эмболии, или газопузырьковой болезни. Она возникает у рыб в результате перенасыщения воды азотом, который поглощается кровью до тех пор, пока концентрации его в крови и в окружающей водной среде не сравняются. Если вода перенасыщена азотом, часть его выделяется в крови в виде пузырьков, которые закупоривают кровеносные сосуды, что может привести к тяжелым последствиям для рыб и даже к их гибели. От газовой эмболии часто страдают рыбы, обитающие у дна искусственных водотоков, где значительная турбулентность способствует поглощению водой азота из пузырьков воздуха в нескольких метрах от поверхности. Когда эти воды снова поднимаются к поверхности, они оказываются перенасыщенными азотом в результате уменьшения давления.1 Следовательно, это обстоятельство необходимо учитывать при проектировании водосливов, рыбоходных шлюзов и других подобных конструкций.
Метан
Метан, или, как его еще называют, «болотный газ», является побочным продуктом анаэробного разложения. В хорошо аэрируемых водах он не продуцируется. Анаэробные условия в озерах чаще всего возникают под термоклином после установления летней стратификации. Сам по себе метан при низких концентрациях, по-видимому, не токсичен для рыб. Однако этот газ продуцируется только в анаэробных условиях, а недостаток кислорода для рыб губителен, поэтому появление метана в системе для культивирования требует принятия неотложных мер. К сожалению, чаще всего его обнаруживают только после замора.
Метан — продукт неполного бактериального разложения органического вещества. Полное разложение, конечными продуктами которого являются двуокись углерода и вода, происходит только в аэробных условиях. Продуцирование метана может происходить при температуре до 5°С. В любой водной системе могут образоваться отдельные области, где происходит анаэробное разложение и накопление метана. В океанах анаэробные условия развиваются в некоторых глубоких впадинах, отделенных от остальных районов океана поднятием дна. Некоторое количество метана обычно поступает в реки и ручьи с болотными водами. Пока анаэробные области занимают незначительную площадь по отношению к площади системы, проблема разрешима. В системах культивирования с высокой плотностью посадки небольшие области с анаэробными условиями имеют тенденцию к быстрому расширению, что приводит к разрушению системы. В связи с этим, за исключением тех случаев, когда преследуются определенные цели (например, денитрификация), необходимо предотвращать развитие условий анаэробного разложения в хозяйствах аквакультуры.
Сероводород
Сероводород, как и метан, является продуктом разложения органического вещества. Летом он часто накапливается в придонных водах озер с развитой стратификацией. В подповерхностных и нижних слоях Черного моря сероводород является преобладающим газом. Некоторые бактерии способны перерабатывать сероводород в присутствии кислорода в чистую серу и воду с выделением энергии:
Частицы серы аккумулируются в телах бактерий, и при исчерпании запасов сероводорода в окружающей среде сера используется ими для продуцирования серной кислоты. Этот процесс также сопровождается выделением энергии:
Другая группа бактерий может утилизировать сульфат и другие соединения серы с образованием сероводорода и выделением энергии.
Сероводород в отличие от метана токсичен для многих водных организмов даже при малых концентрациях, поэтому необходимо предотвращать его продуцирование, поддерживая в системе аэробные условия. Появление сероводорода в системе сопровождается характерным для него неприятным запахом, по которому его легко определить, С помощью аэрации можно удалить присутствующий в воде газ и исключить возможность развития условий для его продуцирования.
Другие газы
В табл. 5.2 представлены концентрации некоторых газов в глубинных океанских водах и в атмосфере. Из таблицы видно, что за исключением кислорода, двуокиси углерода и азота, концентрации газов в глубинных водах очень малы. В настоящее время газы (кроме вышеперечисленных), присутствующие в водной среде, изучены слабо. Их значение для океанских биоресурсов неизвестно, и, по-видимому, в жизни водных организмов они не играют существенной роли.

Список литературы
- The Encyclopedia of Oceanography, Rhodes W. Fairbridge, Ed. (1966). Dow-den, Hutchinson & Ross, Stroudsburg, Pa.
- Harvey, H. W. (1966). The Chemistry and Fertility of Sea Waters, 2nd ed. Cambridge University Press, London.
- Raymont, John E. C. (1963). Plankton and Productivity in the Oceans. Macmillan, New York.
- Reid, George К. (1961). Ecology of Inland Waters and Estuaries. Reinhold, New York.
- Revelle, R. and H. E. Suess (1962). Gases in The Sea, Vol. I, N, M. Hill, Ed. Wiley—Interscience, New York, p. 313.
- Russell—Hunter, W. D. (1970). Aquatic Productivity: An Introduction to Some
- Basis Aspects of Biological Oceanography and Limnology. Macmillan, London.
- Sverdrup, H. U., Martin W. Johnson, and Richard H. Fleming (1942). The
- Oceans—Their Physics, Chemistry and General Biology. Prentice—Hall, Englewood Cliffs. N. J.
- Smith, Emil L. (1938). Limiting Factors in Photosynthesis: Light and Carbon Dioxide. Journal of General Physiology 22: 21—35.
- Takahashi, Taro (1966). Carbon Dioxide Cycle in the Sea and Atmosphere, The Encyclopedia of Oceanography, Encyclopedia of Earth Sciences Series, Vol. 1, Rhodes W. Fairbridge, Ed. Dowden, Hutchinson & Ross, Stroudsburg, Pa.
Примечания
1. В пузырьках парциальное давление азота и кислорода в результате поверхностного натяжения может значительно превышать парциальное давление этих газов в атмосфере.