1) отдача зооксантеллами органических веществ - продуктов их фотосинтеза (ассимилятов) клетками полипа-хозяина,
2) потребление зооксантеллами минеральных форм биогенных злементов (азота и Фосфора) из клеток полипа-хозяина, в которых они накаливаются в результате обмена,
3) интенсификация процесса кальцификации, сопряженной у герматипных кораллов с фотосинтезом их растительна симбионтов.
У свободно живущих дннофлагеллят органическое вещество, продуцируемое ими в процессе фотосинтеза, используется на биосинтез, на обмен и частично выделяется в воду, У эндосимбиотических зооксантелл эта схема меняется под влиянием хозяина. Эволюционный процесс выработал у них реакцию отдачи (транслокании) большей части своей автотрофной продукции. Влияние хозяина на баланс углерода у зооксантелл проявляется в ограничении их размножения, сокращая тем самым расход их продукции на рост. В то же время полип-хозяин стимулирует отдачу ими избытка продуктов фотосинтеза (ассимилятов). Последнее было доказано в опытах с изолированными зооксантеллами (Muscatine et al., 1972; Trench, 1979). Оказалось, что вскоре после окончания процедуры выделения зооксантелл из тканей полипов интенсивность отдачи ими на свету продуктов фотосинтеза быстро снижается. Добавка во взвесь зооксантелл гомогената ткани коралла-хозяина восстанавливает отдачу.
Исследования фотосинтеза зооксантелл и процессов обмена между ними и организмом хозяина были выполнены как на целостных симбионтных организмах, так и на изолированных зооксантеллах (Trench, 1979; Muscatine, 1980). Первые доказательства транслокании зооксантеллами части ассимилятов клеткам хозяина были получены в опытах с актиниями Anthopleura (Muscatine, Hand, 1958). С помощью радиоавтографии было показано, что радиоуглеродная метка, внесенная в виде HC1 4O3 в воду, где сидели актинии, при выдержке их на свету появляется сначала в зооксантеллах, а затем и в тканях самой актинии. Аналогичные данные были получены позже и в опытах с кораллами (Goreau, Goreau, 1960а).
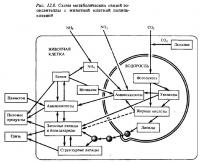
В опытах со взвесью свежевыделенных зооксаетелл кораллов и тридакн было показано, что они экскретируют в воду до 60 и более процентов усвоенного ими при фотосинтезе меченого углерода СО2 (Muscatine, 1967; Von Holt, Von Holt, 1968). Вскоре после выделения зооксантелл из ткани полипов экскреция ими ассимилятов в этих опытах быстро падала. Однако она восстанавливалась после добавки во взвесь гомогената ткани полипов (Trench, 1971). Прогрев гомогената ликвидировал его стимулирующий эффект. Основным продуктом, который выделяли изолированные зооксантеллы, был глицерин (Trench, 1971; Goreau et al., 1973а). Наряду с глицерином изолированные зооксантеллы выделяют аланин, глюкозу и органические кислоты (Lewis, Smith, 1971). Существенно, что свободно живущие динофлагелляты выделяют во внешнюю среду в качестве продукта фотосинтеза не глицерин, а гликолевую кислоту. Если во взвесь изолированных зооксантелл вносили меченую глюкозу, они на свету ее потребляли, выделяя при последующей их экспозиции до 60% потребленного ими в составе глюкозы меченого углерода в виде аланина — С1 4 с примесью глюкозы и глицерина (Muscatine et al., 1972). В присутствии меченого С1 4-ацетата изолированные зооксантеллы на свету в течение считанных минут переводят метку в состав липоидной фракции (Patton, Burris, 1983; Schlichter et al., 1984). То же наблюдалось и в опытах с целыми кораллами. Было установлено, что меченый ацетат на свету усваивается полипами и сразу же переводится в состав фракции фосфолипидов, а затем в состав триглицеридов (Blanguet et al., 1979) (рис.12.7, 12.8).
Таким образом, опыты с изолированными хлоропластами доказали способность зооксантелл выделять более половины своей фотосинтетической продукции in vitro под влиянием гомогената клеток хозяина. В связи с этим возникал вопрос, в какой мере механизм транслокации функционирует в условиях эндосимбиоза in vivo (Muscatine, 1974). Последующие работы показали, что в живых клетках полипов описанный выше путь транслокации ассимилятов в виде глицерина, глюкозы и аминокислот имеет подчиненное значение, а главным механизмом является транслокация зооксантеллами микроскопических капелек жира из своих клеток в клетки хозяина (Crossland et al., 1980; Patton, Burris, 1983). Присутствие таких капелек в зооксантеллах было замечено уже давно (Yonge, Nicholls, 1931). Капельки жира присутствуют в качестве включений в клетках многих свободно живущих динофлагеллят. С другой стороны, было показано, что радиоуглеродная метка карбоната, усвоенная зооксантеллами, через некоторое время обнаруживается в значительном количестве в липоидной фракции клеток полипа-хозяина (Schmitz, Kremer, 1977). Вначале считали, что эти липиды синтезируются в клетках хозяина из поставляемых зооксантеллами путем трапелока-глицерина и жирных кислот (Muscatine et al., 1972). Однако позже стало ясно, что объектом транслокации in vivo являются сами липиды как таковые, которые в виде мелких капелек переносятся из клеток зооксантелл в клетки хозяина с помощью механизма, сходного с обратным пиноцитозом (Crossland et al., 1980; Patton, Burris, 1983). Процесс выделения зооксантеллами капелек жира из своих клеток удалось наблюдать прямо под микроскопом. Часть зооксантелл, изолированных из тканей коралла и выдерживавшихся при сильном освещении, имела на своей поверхности выступающие в виде бугорков капельки жира диаметром 1-5 мкм. Капелька жира отделяется от клетки, оттягивая наружную мембрану зооксантеллы. Отделившись, она оказывается как бы упакованная в мембране зооксантеллы в виде своеобразного пузырька (см. рис. 12.8). Такие инкапсулированные капельки жира могут, по-видимому, циркулировать по соединительным каналам между полипами, так же как они циркулируют в тканях актиний Condylactis gigantea, сходной по многим физиологическим показателям с герматипными кораллами (Kellogg, Patton, 1983). Они же формируют и липидную фракцию слизи, выделяемой полипами склерактиниевых кораллов.
Содержание жира в зооксантеллах, по визуальным определениям, близко к 70%. Жир является главным энергетическим материалом полипов кораллов. Он служит им также и основным запасным веществом и накапливается в них при благоприятных условиях питания (Szamant-Froelich, Pilson, 1980). В тканях герматипных кораллов, таких, как Pocillopora, содержится более 30% жира от сухого их веса. При этом только около 25% липоидного материала представлено структурными липоидами; фосфолипидами, галактолипидами. Остальные 75% липидов (жиров, восков), найденные в тканях коралла, были запасными (Patton et а1., 1977). При этом, как показали последние авторы, липогенез идет, преимущественно в клетках зооксантелл. Действительно, потребление меченого ацетата с последующим появлением метки в липидной фракции оказалось светозависимым. Однако произведенные в зооксантеллах липиды в них не накапливаются, а переходят в клетки полипа, где они формируют жировой запас коралла. Часть этих липидов клетки полипа используют для синтеза восков и воскоподобных соединений, несущих в кораллах не только функцию запасного вещества, но и защитную и структурную функции. В составе запасных липидов кораллов в среднем около половины составляют воскоподобные соединения. Другая их половина представлена триглицеридами. Наряду с липидами зооксантеллы явно транслоцируют и органические соединения азота: аминокислоты и, возможно, пептиды (Lewis, Smith, 1971; Muscatine et al., 1972; Trench, 1974; Burris, 1983; Wafar, 1985). При этом транслокация продуцируемых зооксантеллами органических соединений азота достигает 80%. Продукты фотосинтеза зооксантелл, транслоцированные в полипы, затем могут переноситься из них дальше по колонии в точки наиболее интенсивного роста и кальцификации (Реагле, Muscatine, 1971).
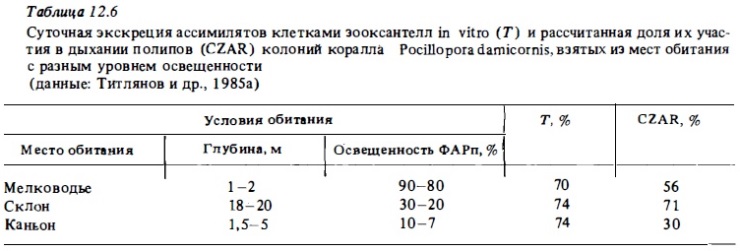
Величину транслокации выражают обычно в процентах от чистой ини валовой продукции зооксантелл. Ее пытались измерить разными способами (Muscatine et al., 1984). В числе этих способов измерение в кратковременных опытах продолжительностью 1 —2 ч распределения усвоенной за это время метки С1 4 между их клетками и веществом самого полипа в опытах с целыми колониями коралла или ее распределение между зооксантеллами и водой, в которой они экспонировались в опытах со взвесью изолированных зооксантелл Muscatine et аl., 1972; Титлянов и др., 1988). Радиоуглеродный метод использовали для измерения транслокации и в более длительных суточных опытах с целыми колониями кораллов, учитывая при этом потерю метки в процессе дыхания. Величины транслокации, полученные с помощью перечисленных методов, варьировали в пределах от 30 до 60%. Метод in vitro давал, как правило, более высокие величины, чем метод in vivo (Muscatine et аl., 1984). Так, в опытах последних авторов средняя величина транслокации у зооксантелл коралла Stylophora pistillata, определенная in vitro, была 55% и определенная in vivo — 38%. В длительном суточном опыте она была наибольшей — 62%. Пример такого определения приводится в табл.12.6.
Оценивая адекватность величины транслокации, полученных радиоуглеродным методом, нетрудно видеть, что они должны быть заниженными, поскольку не только в кратковременном, но даже в суточном опыте транслокация идет в значительной степени за счет немеченых продуктов фотосинтеза, накопленных зооксантеллами до начала опыта (Kellog, Patton, 1983).
В связи с этим Мускатин и др. (1984, 1985) попытались определить величину транслокации (Q) без применения радиоуглеродной метки путем оценки расхода валовой продукции фотосинтеза зооксантелл (Р) на их рост (G) и дыхание (М): Q = Р - (М + G). Величину G определяли, измерив скорость размножения зооксантелл путем подсчета относительного числа клеток, находящихся в стадии деления (двойных клеток). Дыхание зооксантелл вычисляли исходя из их биомассы и удельных трат водорослей на обмен. Величина суточного прироста зооксантелл, согласно этим измерениям, оказалась очень низкой — около 0,10-0,13 в сутки (время одной генерации 50-70 дней). Дыхание зооксантелл составляло всего 5-7% от их суточной автотрофной продукции. Вычисленная на основе этих определений величина транслокации составила около 99% от чистой и около 93% от валовой продукции фотосинтеза зооксантелл. Обратное движение метаболитов из клеток хозяина в клетки симбионта включает прежде всего потребление зооксантеллами биогенных элементов — солевых и некоторых органических форм азота и фосфора. Имеются также доказательства в пользу того, что зооксантеллы могут усваивать из клеток хозяина сложные органические молекулы типа нуклеотидов или полипептидов (обратная транслокация: Thorington, Margulis, 1981).